Формулы химические. — Под названием химических Ф. известна международная система условных знаков, которыми мы выражаем элементарный и процентный состав химически сложных тел, а иногда некоторые их физические и химические свойства. Зачатки ее должны быть отнесены к очень раннему времени, но систематическое применение особых химических знаков, кажется, начинается с XIII в. Так, у Раймунда Луллия семь известных в то время металлов имеют обозначения, тождественные с обозначениями известных тогда тел солнечной системы, а именно:
Происхождение и смысл этих знаков неизвестны точно. Возможно, что знак свинца должен изображать косу Сатурна, знак железа — щит и копье Марса, знак меди — ручное зеркало Венеры и т. п.: тогда их можно рассматривать, как знаки мифологических божеств, под названиями которых были известны металлы; но одинаково вероятно, что эти знаки являются и сокращениями имен тех же божеств. У алхимиков XIV—XVI вв. встречаются и такие объяснения, что замкнутый круг есть знак совершенства металла, полукруг (полумесяц) — знак приближения его к совершенству. Одновременно со знаками металлов с XIII же столетия начинают прививаться следующие обозначения 4 элементов Аристотеля:
наряду с ними придумываются различными писателями и другие знаки, но большинство из них, за исключением разве знака серы (алхимической; см. Флогистон)![]() не получило права гражданства. В 1718 г. Жофруа в своих таблицах химического сродства для металлов удержал данные выше обозначения, но прибавил к ним знаки:
не получило права гражданства. В 1718 г. Жофруа в своих таблицах химического сродства для металлов удержал данные выше обозначения, но прибавил к ним знаки:
и т. д. Очень близким обозначением пользуется иногда и Лавуазье, для которого ("Oeuvres etc. т. II, стр. 515) S. M. обозначает вообще металлическое тело.
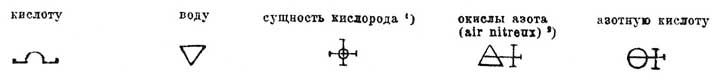
1) Лавуазье смотрел на кислородный газ как на соединение сущности кислорода (principe oxygene) с тепловой материей (calorique — см. Радикалы).
2) Окислы азота, выделяющиеся из азотной кисл. при растворении в ней металлов.
Тем не менее, во многих отношениях Лавуазье должен считаться родоначальником современных химических Ф.; объясняется это тем, что ему мы обязаны исчезновением из химии элементов Аристотеля, что ему (в значительной мере) принадлежит то представление об элементах (см. Вещество, VI, 154; Веса атомов, VII, 658; Лавуазье, XVII, 222; Периодическая законность химических элементов, XXIII, 311), которое сохранилось в химии и по настоящее время; что им же высказан один из основных законов химии — закон сохранения массы материи (см. Химия, законы); что под его влиянием выработался и другой закон — закон постоянства состава химических соединений (закона Proust, см. Химия), и что, наконец, Лавуазье первый показал, что химические превращения могут быть выражены уравнениями (Lavoisier, l. c. стр. 515—527). Более целесообразные знаки предложены в 1787 г. Гассенфратцем и Адетом; их химические Ф. приспособлены уже к антифлогистической (см. Флогистон) теории Лавуазье и имеют некоторые особенности, сохранившиеся впоследствии; а именно Гассенфратц и Адет предложили обозначать элементы возможно простыми знаками и употреблять тождественные знаки для тел, близких по химич. характеру; так, все металлы должны были обозначаться кругами с начальной буквой латинского названия металла в середине, все щелочи и щелочные земли (окислы щелочных и щелочноземельных металлов, отнесенные Лавуазье тоже к числу элементов) — различным образом поставленными треугольниками с латинскими буквами посреди и т. д.; напр.:
Сопоставление этих знаков давало элементарные (качественные) Ф. сложных тел, напр.:
Возрастающее содержание кислорода в окислах азота, известных в то время (вероятно, NO, N2O4 и N2O5), они выражали Ф.
Эта количественная сторона нашла отчетливое и точное выражение в атомной теории Дальтона (см. Вещество, Веса атомов и Химия) и в предложенных им Ф., которые, впрочем, в других отношениях являлись малоудобными и потому не привились; исходя из убеждения в шарообразности атомов, Дальтон их изображал кругами, отличавшимися друг от друга различными условными знаками. Напр., по Дальтону:
1) Эти окиси не были еще разложены на составные части.
Каждому из своих атомов Дальтон приписывал определенный относительный вес, и следовательно, его Ф. должны были выражать и точный состав данных тел, и число атомов, входящих в состав их молекул; но так как, с другой стороны, в установлении последних величин Дальтон руководствовался совершенно произвольными соображениями (см. Химия), то и веса атомов и Ф. соединений у него часто менялись (ср. Н. Roscoe and A. Harden, «A New View of the Origin of Dalton’s Atomic Theory», 1896, напр. стр. 45—46). Наконец, чисто буквенное обозначение, сохранившееся до нашего времени, введено Берцелиусом, начиная с 1815 г. Впрочем, Берцелиус обыкновенно обозначал кислород точками, а потому его Ф. в этом отношении отличаются от современных; таковы, напр., Ф. Берцелиуса (1826 г.):
Такие Ф. выражают прежде всего точно качественный (элементарный) и процентный состав тел[1]); так, напр., Φ. Cu2О показывает, что закись меди образована соединением меди (2-х атомов) с кислородом (1-м атомом) и содержит на 126 вес. частей меди (Cu = 63 в круглых цифрах — ср. Веса атомов, VII, 660, — a Cu2 = 2 x 63) — 16 вес. частей кислорода (О = 16), а отсюда по пропорции 142 : 126 = 100 : x (где 142 = 126 + 16) мы узнаем, что в закиси меди почти 88,73% меди и 11,26% кислорода[2]). Обратно, зная элементарный и % состав какого-нибудь соединения, мы можем вычислить его Ф.; действительно, если дано, что тело образовано соединением меди с кислородом и содержит 88,73% Cu и 11,26% О и мы знаем, что атомный вес меди Cu = 63, а кислорода — Ό = 16, то ясно, что в 100 вес. частях его содержится 88,73 : 63 = 1,40 ат. меди, выраженного в тех же весовых единицах, и 11,26 : 16 = 0,70 атомов кислорода; эти частные относятся друг к другу как 2 : 1 = 1,4 : 0,7 и, следов., в соединении на каждый атом кислорода приходится два атома меди, т. е. его простейшая Φ. Cu2О, но возможна и кратная CunOn, где n неопределенное целое число. Выбор между этими Ф. не может быть сделан на основании только % данных, и подобные вопросы решаются с значительной степенью достоверности только в случае летучести соединения, когда величина его молекулы выводится на основании положения Авогадро-Ампера (см. Химия). Из примера ясно и общее правило для вывода Ф. из аналитических данных; оно следующее: процентные числа, указывающие содержания данных элементов в соединении и добытые при его количественном анализе, должны быть разделены на соответственные атомные веса; полученные частные дадут тогда доли атомов, содержащиеся в 100 вес. частях соединения; если затем принять наименьшее из них за новую единицу измерения, т. е. разделить все частные на наименьшее из них, то мы узнаем, какие доли атомов других элементов приходятся на один атом этого элемента; если новые частные выражаются целыми числами, то, значит, найдена наиболее простая Ф. соединения, но если они представляют не целые, а дробные числа, то необходимо подобрать то наименьшее целое число, которое может превратить эти дробные числа в целые[3]); очень часто полученная этим путем Ф. подлежит еще дальнейшему усложнению в зависимости от химических аналогий вещества и его превращений.
Если данное тело летуче, то его химическая Ф. позволяет вычислить удельный вес его пара по водороду или же кислороду[4]). Дело в том, что все современные Ф. представляют состав молекул и они выведены согласно положению Авогадро-Ампера (см. Химия), требующему, чтобы молекулы всех тел в газообразном состоянии занимали (при равных условиях температуры и давления) равные объемы; следовательно, современные Ф. равнообъемны для парогазообразных веществ; и так как удельный вес представляет не что иное, как отношение масс равных объемов разных тел, из которых одно принято за единицу сравнения, то для получения уд. веса по водороду должно разделить молекулярную Ф. данного тела на вес молекулы водорода, равный 2, если вес водородного атома условно приравнен единице и атомные веса всех тел, входящих в данную Ф., тоже отнесены к Н = 1; ср. Веса атомов. Если же требуется узнать уд. вес данного тела в парообразном состоянии по кислороду, то его молекулярный вес, вес его Ф., должен быть разделен на вес молекулы кислорода, т. е. на 32, если атомный вес О = 16 и атомные веса всех элементов, встречаемых в данной Ф., отнесены к кислороду = 16[5]); иначе, если сумма весов всех атомов в данной Ф. равна M (при H = 1), то уд. вес по водороду такого пара = M2, т. е. — половине молекулярного веса, а если она (при О = 16) равна М′, то уд. вес того же пара по кислороду = М′32. Частное, представляющее теоретически уд. вес по водороду, можно найти постоянно в мемуарах по органической химии, но должно заметить, что тут оно вполне условно и не представляет действительного теоретического уд. веса по водороду (при Н = 1), так как молекулярный вес вычисляется авторами с помощью округленных атомных весов (напр. Н = 1, О = 16, С = 12, N = 14 и т. д.), не отвечающих реальным величинам, а имеющих за себя только некоторое удобство расчета (два знака, а не 4) и малую точность общеупотребительных методов определения плотности парообразных тел (Гофманна, В. Мейера и др.). Точно так же легко вычислить по Ф. с точностью, вполне достаточной для различных практических целей, вес 1 литра данного пара. Для этого необходимо разделить молекулярный вес, выражаемый данной Ф., при Н = 1, на 22,204 (по Morley) или же 22,203 (Rayleigh)[6]), a когда атомные веса взяты по кислороду = 16, то на 22,385 (по Rayleigh) или 22,386 (по Morley)[7]): найденные величины, т. е. М22,204, М22,203 или же М′22,385, М′22,386 и будут представлять вес 1 литра данного пара при 0° Ц. и 760 мм давления ртутного столба (при условиях Парижа)[8]); если требуется узнать ту же величину для других температур и давлений, то можно найти ее, предполагая, что в первом приближении к парам приложимы законы Бойля-Мариотта и Шарля Гей-Люссака (см. Газы). Обратная задача вычисления веса грамм-молекулы по весу 1 литра газа понятна сама собою. О вычисляемом по Ф. коэффициенте светопреломления — см. Светопреломляющая и светорассеивающая способность химических соединений (XXIX, 226), о возможности предвидеть на основании Ф. строения органических веществ их химическую функцию — см. Химическое строение и их вращательное влияние на плоскость поляризации прямолинейно поляризованного луча — См. Стереохимия и Стереоизомерия (XXXI, 609—627), а также Вращательная способность химических соединений (VII, 345).
Течение химических реакций выражается так наз. химическими уравнениями, первыми примерами которых, как указано выше, мы обязаны Лавуазье. Строятся эти уравнения следующим образом. Слева от знака равенства ставятся соединенные знаками + Ф. различных участвующих в реакции тел; слева от каждой Ф. ставится некоторый коэффициент (при отсутствии его считается, что он = 1), который обозначает число участвующих в реакции молекул (объемов, если реакция идет в парогазообразном состоянии); справа от знака равенства пишут точно таким же образом Ф. образующихся по окончании реакции молекул и число их. Благодаря этому химическое уравнение должно бы представлять качественно и количественно химическое состояние системы до и после превращения. Понятно, что для этого коэффициенты таких уравнений должны устанавливаться опытом. Подобные опытные уравнения, изображающие течение реакции при данных условиях, действительно и известны во многих случаях (см. работы В. Roozeboom’a и его учеников в «Zeitschr. f. ph. Cheime»); но большинство уравнений, приводимых в учебниках по неорганической химии, и почти все, за немногими исключениями, уравнения учебников органической химии имеют целью не изображение действительно идущих процессов, ход которых в зависимости от различных условий пока еще нам мало известен, а они изображают некоторые идеальные процессы, которые могли бы иметь место, если бы из взятой системы тел образовывалась только некоторая качественно определенная система других тел. Для определения коэффициентов таких уравнений мы уже не пользуемся количественными химическими анализами, а ограничиваемся некоторыми качественными аналитическими указаниями и строим уравнение на основании закона Лавуазье о сохранении массы материи при химических превращениях. Так, напр., представим себе, что мы установили бы качественно, что при некоторых условиях система из меди (Cu) и азотной кислоты (HNO3) была бы способна нацело превращаться в систему из азотно-медной соли (Cu[HNO3]2), воды — Н2О и окиси азота — NO; спрашивается, каким уравнением можно было бы передать такой процесс; полученное уравнение, как не отвечающее действительно идущей реакции, имело бы исключительно мнемоническое значение. Для отыскания уравнения можно было бы написать его таким образом: xCu + yHNO3 = zCu(HNO3)2 + uН2О + vNO, а затем решить, имея в виду, что для меди: x = z, для водорода у = 2u, для азота у = 2z + v и для кислорода 3у = 6z + u + v, откуда окончательное уравнение имеет вид xCu + 8x3HNO3 = xCu(HNO3)2 + 4x3Н2О + 2x3NO, или же, приводя к одному знаменателю и сокращая x: 3Cu + 8HNO3 = 3Cu(NO3)2 + 4H2O + 2NO. Это и есть уравнение, которое дается обыкновенно в учебниках (относительно метода решения таких уравнений на основании рассмотрения возможных реакций см. Д. И. Менделеев, «Основы химии», 6-е изд., 1895, стр. 199, прим. 41 и стр. 205 и О. С. Johnson, «Chem. News» 42, 1880, 51, и J. Bottomley, «Chem. News» 37, 1878, 110). Указанный прием приводит к цели только тогда, когда искомое уравнение отвечает одной реакции, а не нескольким последовательно идущим превращениям; в последнем случае окончательное уравнение остается неопределенным; так, напр., известно, что при нагревании бертолетовой соли образуются: хлористый калий — KCl, кислород — О2 и хлорно-калиевая соль — KClO4, т. е. xKClO3 = yО2 + zKCl + uKClO4, откуда для калия и хлора: x = z + и и для кислорода 3x = 2y + 4и; условия, очевидно, неопределенные и этим объясняется, что в одних учебниках реакция передается уравнением 2KClO3 = О2 + KCl + KClO4, а в других 62KClO3 = 7О2 + 5KCl + KClO4; их можно еще написать бесчисленное множество, так как одно из возможных общих решений передается формулой 2(x + 2у)KClO3 = 3xО2 + (2x + у)KCl + 3уKClO4 [9]). Как на дальнейшие примеры таких неопределенных реакций можно указать на образование ортофосфорной кислоты при взаимодействии фосфора, йода и воды, которое иногда передается уравнением 9J + 13Р + 24Н2О = 6Н3РО4 + 2HJ + 7РН4J, а иногда: 2J + 2P + 4Н2О = Н3РО4 + HJ + РН4J, и где одно из решений дается формулой: 5(x + y)J2 + 2(x + 9у)Р + 8(x + 4у)Н2О = 2(x + 4у)Н3РО4 + 10xHJ + 10yРН4J, или на взаимодействие тех же тел с образованием пирофосфорной кислоты, которое обыкновенно передается уравнением А. В. Гофмана: 13Р + 9J + 21Н2О = 7PH4J + 2HJ + 3Н4P2O7, между тем как его можно написать и 5J + 9Р + 14Н2О = 5PH4J + 2Н4P2O7, и 4J + 4P + 7H2O = 2PH4J + 2HJ + Н4P2O7, и 14J + 22Р + 35H2O = 12PH4J + 2HJ + 5Н4P2O7, и многими другими способами, так как одно из возможных выражений есть: 2(9x + y)Р + 5(x + у)J2 + 7(4x + y)Н2О = 10xPH4J + 10yHJ + (4x + y)Н4P2O7; во всех подобных случаях x и у могут быть порознь приравнены нулю, но могут иметь значение и любых целых чисел. Относительно некоторых условных знаков, встречаемых теперь во многих химических уравнениях, см. van’t Hoff, «Etudes de dynamique chimique»; В. Roozeboom, «Recueil Trav. Pays-Bas» 3, 1884, 29 («Zeitschr. f. ph. Chemie» 2, 1888, 450) и H. Marschall, «Proc. R. Soc. Edinburgh» 24, 1902, II, 85—87 («Zeitschr. f. ph. Ch. 41, 1902, 103). А. И. Горбов.
- ↑ Предполагается, что дана хорошо установленная Ф. вещества, образованного соединением элементов с точно установленными атомными весами.
- ↑ Процентное содержание элементов в соединении вычисляется обыкновенно с двумя десятичными знаками, потому что опытные данные, на основании которых строится данная Ф., обыкновенно слишком мало точны. В данном примере вычисление третьего десятичного знака уже потому не имеет никакого смысла, что для вычисления взят не точный атомный вес меди, а приблизительный (ср. Küster, «Logarithmische Rechentafeln» etc.).
- ↑ По причине ошибок анализа и связанной с ними неточности опытных процентных чисел — указанным путем, собственно говоря, никогда не удается прийти к целым числам. Довольствуются потому такой формулой, из которой обратно может быть вычислено процентное содержание элементов, сходящееся в пределах 0,2%, иногда и 0,5%, с опытными процентными числами.
- ↑ В последнее время принято эти два газа считать единицами сравнения. В мемуарах по органической химии можно и теперь, впрочем, найти уд. веса газов по воздуху; для получения этих величин молекулярный вес газа должен быть разделен на 28,83 = 1,293 x 22,3, где 1,293 — округленный вес в граммах 1 литра воздуха, а 22,3 тоже округленный, т. е. неточный, объем грамм-молекулы (см. ниже прим. об объемах грамм-молекул Н2 и О2). Прием этот неправилен и с течением времени выведется сам собою.
- ↑ Если атомные веса отнесены не к кислороду = 16, а к водороду = 1, то для определения уд. веса данного вещества по кислороду следует разделить его молекулярный вес на 31,74 = 2 x 15,87, где 15,87 представляет атомный вес кислорода (по Morley’ю) при Н = 1; точно так же, если принятые атомные веса отнесены к O = 16, то для вычисления уд. веса пара данного тела по водороду его молекулярную Ф. следует делить не на 2, а на 2,0163, т. е. на величину молекулы водорода при О2 = 32.
- ↑ Цифры 22,203 и 22,204 представляют объем грамм-молекулы водорода при Н = 1, т. е. объем 2 гр. его в литрах при 0°Ц. и 760 мм давления ртутного столба.
- ↑ Цифры 22,385—22,386 представляют объем в литрах грамм-молекулы кислорода при О = 16, т е. 32 гр. его. У Dammer’a («Handbuch d. anorg. Ch.» IV, 1902, 8) эта величина вычислена = 22,420.
- ↑ Для веса 1 литра кислорода принято число 1,42945, вычисленное Travers’ом (M. W. Travers, «Study of Gases», 1901, 133) для Парижа; оригинальное число Morley’я 1,42900.
- ↑ Другие уравнения могут быть, напр., 2(x + 2у)KClO2 = xO2 + (x + y)KCl + (x + 3у)KClO4, 4KClO3 = 2уО2 + (x + y)KCl + (3x — у)KClO4 и т. д. Каждое из них указывает на возможность двух независимых реакций; для различных уравнений эти реакции различны. Это замечание прилагается и к другим приведенным в тексте примерам неопределенных реакций.