Нитропарафины (хим.) — представляют производные предельных углеводородов, в которых один или несколько атомов водорода замещены одноатомным остатком азотной кислоты ![]() , называемым обыкновенно нитрогруппой. Мононитропарафины, вещества общей формулы — CnH2n+1(NO2) образуются: 1) при действии азотисто-кислого серебра на галоидангидриды (преимущественно йодангидриды — йодюры) спиртов (В. Мейер и его ученики): СnН2n+1J+AgON2=CnН2n+1NO2+AgJ; одновременно с Н. получаются нормальные продукты реакции, азотисто-кислые эфиры; относительные количества Н. и эфира подвержены значительным колебаниям: из йодистого метила образуется главным образом нитрометан — CH3.NO2; из гомологов йодистого метила наибольшее количество Н. дают нормальные первичные йодюры; при вторичных — получается уже больше эфира, а из третичного йодистого бутила (йодюра триметилкарбинола) едва удается реакцией В. Мейера получить небольшое количество нитробутана — (СН3)3.С.NO2 — главным же продуктом реакции является эфир (СН3)3.С.О.N:О; 2) при действии азотисто-калиевой (азотисто-серебряной соли) на α-моногалоидозамещенные жирные кислоты (Кольбе, Прейбиш, Колотов):
, называемым обыкновенно нитрогруппой. Мононитропарафины, вещества общей формулы — CnH2n+1(NO2) образуются: 1) при действии азотисто-кислого серебра на галоидангидриды (преимущественно йодангидриды — йодюры) спиртов (В. Мейер и его ученики): СnН2n+1J+AgON2=CnН2n+1NO2+AgJ; одновременно с Н. получаются нормальные продукты реакции, азотисто-кислые эфиры; относительные количества Н. и эфира подвержены значительным колебаниям: из йодистого метила образуется главным образом нитрометан — CH3.NO2; из гомологов йодистого метила наибольшее количество Н. дают нормальные первичные йодюры; при вторичных — получается уже больше эфира, а из третичного йодистого бутила (йодюра триметилкарбинола) едва удается реакцией В. Мейера получить небольшое количество нитробутана — (СН3)3.С.NO2 — главным же продуктом реакции является эфир (СН3)3.С.О.N:О; 2) при действии азотисто-калиевой (азотисто-серебряной соли) на α-моногалоидозамещенные жирные кислоты (Кольбе, Прейбиш, Колотов):
CH2Cl.COOK + KNO2 + H2O = CH2(NO2).COOK + KCl + Н2O = CH3.NO2 + НКСО3 + KCl;
3) Н. образуются при перегонке солей спиртосерных кислот с азотисто-натриевой солью (Лаутербах):
C2H5.O.SO2.OK + NaNO2 = C2H5.NO2 + KNaSO2;
4) Н. могут быть получены прямым нитрованием парафинов слабой азотной кислотой (уд. в. 1,036 — 1,075 и несколько выше) при нагревании в запаянных трубках (под давлением) при температуре 120 — 140°С (M. Коновалов):
CH3.[CH2]4.CH3 + HNO3 = СН3.[СН2]3.СН(NO2).СН3 + Н2O;
5) наконец, при действии цинкалкилов на галоидозамещенные Н.(см. ниже) можно перейти от низших Н. к высшим Н. (Бевад):
2CH3.CHBr.NO2 + Zn(C2H5)2 = ZnBr2 + 2CH3.CH(NO2).С2Н5.
По положению нитрогруппы различают: Н. первичные — R′.CH2.NO2, вторичные — R′.CH(NO2).R′I и третичные [1] (R′, R′I и R′II):C.NO2 (о химическом различии между ними см. ниже); перечисленными реакциями могут быть получены: способом В. Мейера — все Н., способом Кольбе — первичные и вторичные; способами М. Коновалова и Бевада — вторичные и третичные; относительно реакции Лаутербаха ничего определенного сказать нельзя. Н. представляют бесцветные жидкости, перегоняющиеся без разложения, обладающие приятным своеобразным запахом; в воде они почти не растворимы. Низшие члены ряда тяжелее воды; с увеличением частичного веса уд. в. падает, и нитробутан уже легче воды; по обыкновению, уд. в. и точка кипения первичных и нормальных Н. выше уд. в. и точек кипения соответственных вторичных и третичных производных. Химический характер Н. во многих отношениях своеобразен. Первичные и вторичные Н. обладают кислыми свойствами и способны давать соли, из которых Н. могут быть выделены обратно; третичные Н. — совершенно нейтральные вещества. Из солей первичных и вторичных Н. особенно важны (для очищения) натриевые, получаемые в виде труднорастворимых белых кристаллических осадков при осаждении эфиром смеси водно-спиртового раствора Н. с водно-спиртовым раствором едкого натра; эти соли содержат всегда только один атом металла; сухие соли Н. принадлежат к числу сильновзрывчатых веществ (ср. ниже о ртутном производном нитрометана). Кислотный характер Н., несомненно, связан с присутствием при углеродном атоме, соединенном с нитрогруппой, водородных атомов, способных к замещению; это видно как из нейтральности третичных Н., так и из того, что у вторичных монобромонитросоединений (см. ниже), характеризуемых группой — ′″C.CBr(NO2) — С″′ тоже отсутствует способность к растворению в щелочах, между тем как первичные монобромонитропарафины, содержащие группу — ′CHBr(NO2), еще представляют слабые кислоты. Особая подвижность этих водородных атомов сказывается еще и в следующих реакциях Н. Если на соль первичного или вторичного Н. действовать бромом, то образуются монобромосоединения [2] за счет замещения одного атома водорода бромом (на свободные Н. бром не действует):
Вторичное бромосоединение, как только что указано, представляет нейтральное вещество, а первичное дает соли:
эти соли опять могут реагировать с бромом, образуя двубромопроизводные:
обладающие уже нейтральным характером; двубромопроизводные образуются прямо действием брома на раствор первичного Н. в избытке щелочи (В. Мейер, Черняк и др.). Если смешать (1 мол.) нитрометана (см. ниже) с продажным раствором (3 мол.) муравьиного альдегида (см. Оксиметилен) и прибавить к смеси небольшое количество поташа, то наблюдается очень энергичная реакция, дающая по уравнению: NO2.CH3+3НаСО=NO2.C[CH2(OH)]3 — количественно нитроизобутилглицерин, кристаллизующийся в прекрасных бесцветных призмах, кип. при 158—159°С; с нитроэтаном оксиметилен реагирует столь же гладко, но в реакцию вступают не 3 мол. альдегида, а только две:
и образуется плавящийся при 139—140° нитроизобутигликоль; наконец, со вторичным нитропаном оксиметилен дает пл. при 82° нитроизобутиловый спирт:
Таким образом, в реакцию с Н. вступают каждый раз столько молекул оксиметилена, сколько имеется атомов водорода при углероде, соединенном с нитрогруппой (Анри) [3].
Кислотами при нагревании Н. разлагаются; направление разложения зависит от строения Н. и от условий реакции. Первичные Н. при нагревании с минеральными кислотами образуют, присоединяя элементы воды, гидроксиламин и жирную кислоту, имеющую столько же атомов углерода, сколько их было в Н.: R′.CH2.NO2+НОН=H2N(OH)+R′.CO(OH) (Прейбиш, Мейер и Лохер, Кисель); вторичные и третичные, по-видимому, при прямом действии кислот осмоляются (? В. Мейер) [4]. Если действовать кислотой не на свободный Н., а на его натриевую соль (кислота должна быть крепкая и лучше неорганическая), то вместо гидроксиламина наблюдается закись азота, а, с другой стороны, из первичных Н. получаются альдегиды, а из вторичных — кетоны (Неф, В. Мейер, М. Коновалов):
2R′.CHNa.NO2 + 2HCl = 2R′. CHO + 2NaCl + N2O + H2O и
2R′.CNa(NO2).R’I + 2HCl = 2R′.CO.R’I + 2NaCl + N2O + H2O [5]. Под влиянием щелочей Н. тоже изменяются; отчасти реакция состоит в том, что щелочи отнимают (от первичных и вторичных Н.) азотистую кислоту, но натура одновременно образующихся продуктов выяснена хорошо только для нитроэтана [6]. Под влиянием азотистой кислоты, в момент выделения, первичные Н. образуют нитроловые кисл. (см.):
R′.CH2.NO2 + ON(OH) = R′.C(NO2)(NOH) + H2O,
легко узнаваемые по кроваво-красному окрашиванию их щелочных солей, а вторичные Н. — изомерные с нитроловыми кислотами — псевдонитролы:
R′.CH(NO2).R′1 + ON(OH) = R′.C(ON)(NO2).R′1 + H2O,
нейтральные вещества, в жидком состоянии окрашенные в интенсивный синий цвет. Так как третичные Н. не реагируют совершенно с азотистой кислотой, то В. Мейером выработан очень изящный и быстрый способ, позволяющий решать натуру (первичную, вторичную, третичную) йодангидридов спиртов. Данный йодюр для этого нагревают с азотисто-кислым серебром, образующийся перегон взбалтывают с раствором азотисто-калиевой соли в крепком щелоке, разбавляют водой и по каплям приливают разбавленную серную кислоту. Красное окрашивание, исчезающее при кислой реакции и снова появляющееся при прибавлении щелочей (см. Нитроловые кислоты), указывает на первичный йодюр; синяя (или зеленовато-синяя) окраска, переходящая в хлороформ при взбалтывании с ним — указывает на вторичный йодюр (ср. Псевдонитролы), и наконец, отсутствие всякой окраски возможно при третичном йодюре. Необходимо, однако, заметить, что безошибочные указания можно получить (даже с 0,5 — 0,3 г йодюра) только с йодюрами, содержащими не более 4 атомов углерода в частице; с йодюрами высших спиртов реакция образования нитропроизводных идет недостаточно гладко, чтобы дать безошибочные качественные указания. Под влиянием водорода в момент выделения, все Н. превращаются в конце концов в соответственные амины, например:
CH3.NO2 + 3H2 = CH3.NH2 + 2H2O;
CH3CH(NO2).CH3 + 3H2 = CH3.CH(NH2)СН3 + 2Н2О
и
(СН3)3.C.NO2 + 3H2 = (СН3)3.С.NH2 + 2H2O
(реакция важна для выяснения строения Н., так как она заставляет принимать, что азот нитрогруппы непосредственно связан в них с углеродом), но натура промежуточных продуктов еще недостаточно выяснена; для первичных Н. можно считать твердо установленным, что первоначально образуются замещенные гидроксиламины (В. Мейер с Э. Гофманом и Кирпаль; Е. Бамбергер), напр. из CH3.NO2 — нитрометана — СН3.HN(OH) — метилгидроксиламин, но для вторичных и третичных жирных нитросоединений соответственные замещенные гидроксиламины еще не описаны; образование их, однако, вероятно, так как из нитробензола C6H5.NO2 получен, при восстановлении в нейтральной среде (цинковая пыль и вода) — фенилгидроксиламин (Е. Бамбергер, Воль, Люмьеры и Зейевиц). Необходимо заметить, что при восстановлении в кислой среде наряду с аминами из первичных Н. получаются еще альдегиды, а из вторичных — кетоны (М. Коновалов); образование их, вероятно, объясняется отношением Н. к кисл. (см. выше), но мыслима, напр., и такая реакция:
R′.СН2.NO2 + H2 + HCl. = R′.CHO + H2N(OH).HCl.
— Сопоставляем свойства некоторых Н. и их производных. Нитрометан — жидкость, кипящая при 101°; со спиртовым раствором едкого натра образует кристаллический осадок состава — СН2Na(NO2) + С2H6О, выветривающийся над серной кисл. с потерей спирта; натриевая соль с сулемой дает желтую ртутную соль — Hg(CH2.NO2)2, способную, с потерей двух частиц воды, превращаться в гремуче-кислую ртуть
(Неф): Hg(CH2.NO2)2 — 2H2O = Hg(CNO)2
и потому сильно взрывчатую [7]; метилнитроловая кислота — CH(:NOH).NO2 плавится при 64°; бромнитрометан — CH2Br2NO2 кипит около 143° и представляет довольно сильную кислоту, дибромнитрометан — CHBr2.NO2 кипит около 160° и представляет единственное дибромопроизводное первичного Н., еще растворимое в щелочах и при дальнейшем замещении бромом дающее трибромнитрометан — CBr3(NO2), более известный под названием бромпикрина (см. Хлорпикрин). Нитроэтан — СН3.CH2NO2 жидкость, кип. при 114°; натриевая соль — CH3.CHNa(NO2) с сулемой дает постоянную, хорошо кристаллизующуюся соль — CH3.CH(NO2).HgCl; этилнитроловая кисл. — СН3.СН(NOH).NO2 плавится при 81°; монобромнитроэтан — СН3CHBr(NO2) — кипит при 146°, а дибромнитроэтан — CH3.CBr2(NO2) — при 165°. Третичный нитробутан — (CH3)3.CNO2 представляет кристаллическое вещество, плавящ. при 23° — 24° и кип. при 126°; от предыдущих нитросоединений он отличается отрицательными свойствами: неспособностью растворяться в щелочах, неспособностью реагировать с азотистой кислотой и неспособностью давать бромопроизводные. Вторичный нитрогексан — СН3.CH(NO2).СН2.СН2.СН2.СН3 — жидкость, кипящая при 175° — 176°, растворимая в едких щелочах, с азотистой кислотою дающая псевдонитрол (см.) и при действии брома на щелочной раствор — монобромопроизводное — CH3.CBr(NO2).[CH2]3.CH3, обладающее нейтральной реакцией и не растворимое в щелочах. Описано еще много других Н. Способы получения полинитропарафинов и их свойства исследованы менее хорошо. Динитропарафины общей формулы — R′.CH(NO2)2 образуются при действии азотистых солей на монобромопроизводные R′.CHBr(ON)2 (Тер-Меер и В. Мейер)
KNO2 + R′.CHBr(NO2) = KBr + R′.СН(NO2)2
и при окислении крепкой азотной кислотой кетонов (Шансель), особенно содержащих одну метильную группу:
R′.CO.CH3 + 2HNO3 = R′.CH(NO2)2 + CH2O2 (муравьиная кисл.) + Н2О.
Динитропарафины общей формулы R′C(NO2)2.R’ образуются при окислении псевдонитролов хромовой кислотой в уксусно-кислом растворе (В. Мейер и Лохер):
R′.C(NO)(NO2).R1’ + O = R′.C(NO2)2.R1′.
Динитрогексан — (CH3)2.С(NO2).(NO2).С(СН3)2 получен Зелинским при электролизе соли вторичного нитропропана
2(СН3)2.CNa(NO2) — Na2 = C6H12N2О4
и М. Коновиловым прямым нитрованием диизопропила:
(СН3)2.СН.СН.(СН3)2 + 2HNO3 = С6H12N2O4 + 2H2О.
Может быть, полинитропарафины образуются при реакции Демьянова, состоящей в действии азотного ангидрида на углеводороды этиленного ряда. По химическим реакциям динитропарафины до известной степени напоминают мононитропроизводные.
Примечания
править- ↑ R′, R′I и R′II — одноатомные остатки предельных углеводородов.
- ↑ Бромопроизводные Н. представляют высококипящие жидкости, способные (некоторые только под уменьшенным давлением) перегоняться без разложения; запах острый, напоминающий запах хлорпикрина.
- ↑ Реакция других альдегидов с нитрометаном идет менее энергично, и количество частиц альдегида, вступающих в реакцию, не отвечает числу водородных атомов нитрометана: так, обыкновенный альдегид образует нитроизопропиловый спирт: СН3.CHO+Н.СН2NO2=СН3СН(ОН).СН2.NO2 (Анри).
- ↑ Можно думать, что из третичных Н. образуются, при действии кислот, кетоны, содержащие одним атомом углерода в частице меньше (М. Коновалов).
- ↑ Благодаря возможности такой реакции, рекомендуется натриевые соли Н. разлагать или слабыми минеральными кислотами, каковы: угольная, борная, еще лучше сероводород (М. Коновалов), или слабой органической, напр. разбавленной уксусной (Голлеман, В. Мейер).
- ↑ Н. Соколов (и Геттинг) показали, что при этом образуется обладающая характерным пиридинным запахом жидкость, кипящая при 171°, состава — C6H9NO. Дунстан и Даймонд получили ее затем действием гидроксиламина на μ-метилацетилацетон — CH3СО.СН(СН3).CO.CH3 и показали, что она есть не что иное, как триметилизоксацол —
 (принимая для изоисацолов строение, предложенное Клайзеном).
(принимая для изоисацолов строение, предложенное Клайзеном).
- ↑ Этим открытием Нефа вполне решается вопрос о строении гремуче-кислых солей и самой гремучей кислоты; так, на основании превращения ртутного производного нитрометана в гремучую ртуть формула этой последней, вероятно:
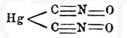 (ср. Гремучие соли). Впрочем, сам Неф считает гремучую кисл. оксимомокиси углерода, т. е. дает ей формулу C = N(OH), принимая углерод в ней двухатомным.
(ср. Гремучие соли). Впрочем, сам Неф считает гремучую кисл. оксимомокиси углерода, т. е. дает ей формулу C = N(OH), принимая углерод в ней двухатомным.
