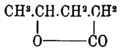Лактоны (хим.) — представляют особый вид ангидридных производных оксикислот (см.), так назыв. внутрение их ангидриды[1]. Хотя некоторые из Л. (напр. кумарин, теребиновая кислота и др.) были известны уже с давних пор, но изучены они, к как следует, лишь в последние 15 лет, главным образом, Фиттигом с сотрудниками, которому принадлежит как правильное установление натуры этих соединений, так и самое название «Л.»[2]. Заключая в своем составе алкогольные и кислотные водные группы, оксикислоты способны при взаимодействии их частиц между собой образовать при выделении воды сложные эфиры. При этом, если в реакции участвуют две частицы оксикислоты, из которых одна функционирует как спирт, а другая как кислота, то при выделении одной частицы воды образуются так назыв. лактидные эфиры, т. е. неполные сложные эфиры оксикислот. Таков, напр., ангидрид молочной кислоты (см.) или безводная молочная кислота, образующаяся по уравнению: 2CH3.CH(OH).COHO—H2O=СН3.CH(СОНО).О.СО.CH(OH).СН3. При выделении из двух частиц оксикислоты двух частиц воды образуются полные эфиры или ангидриды оксикислот замкнутого строения Таковы, напр., для той же молочной кислоты лактид  и для гликолевой (см.) гликолид
и для гликолевой (см.) гликолид  . Но, подобно тому, как это имеет место при образовании ангидридов двуосновных кислот и простых эфиров гликолей, возможно выделение одной частицы воды из одной частицы оксикислоты или так назыв. внутренняя их этерификация, в результате которой и являются Л., тоже вещества замкнутого строения, напр.:
. Но, подобно тому, как это имеет место при образовании ангидридов двуосновных кислот и простых эфиров гликолей, возможно выделение одной частицы воды из одной частицы оксикислоты или так назыв. внутренняя их этерификация, в результате которой и являются Л., тоже вещества замкнутого строения, напр.:  Однако, не всякие оксикислоты способны образовать Л., а лишь γ и δ, т. е. те, которые при переходе в Л. дают пяти- и шестичленные кольца[3]. Объяснение этому с точки зрения стереохимии см. в ст. Имиды. Стремление γ- и δ-оксикислот к образованию Л. столь велико, что самые кислоты в свободном состоянии едва известны и даже в тех случаях, когда можно было бы ждать их образования (напр., при разложении солей кислотами), они, теряя воду, дают соответствующие Л. Обыкновенно Л. и получают кипячением (в течение нескольких минут) водных растворов солей γ- и δ-оксикислот[4] с серной кислотой, затем извлекают эфиром и, по испарении последнего, сушат прокаленным поташом и очищают перегонкой; γ-Л. получаются, кроме того, превращением изомерных им непредельных кислот, у которых двойная связь находится между β- и γ- или γ- и δ-углеродными атомами. Такое превращение названных кислот происходит при нагревании их в водных растворах с разбавленной серной кислотой, при присоединении к ним бромистого водорода и обратном отщеплении его (с помощью нейтрализации полученных γ-бромокислот углекислыми щелочами или кипячения их с водой), или даже просто при перегонке, например:
Однако, не всякие оксикислоты способны образовать Л., а лишь γ и δ, т. е. те, которые при переходе в Л. дают пяти- и шестичленные кольца[3]. Объяснение этому с точки зрения стереохимии см. в ст. Имиды. Стремление γ- и δ-оксикислот к образованию Л. столь велико, что самые кислоты в свободном состоянии едва известны и даже в тех случаях, когда можно было бы ждать их образования (напр., при разложении солей кислотами), они, теряя воду, дают соответствующие Л. Обыкновенно Л. и получают кипячением (в течение нескольких минут) водных растворов солей γ- и δ-оксикислот[4] с серной кислотой, затем извлекают эфиром и, по испарении последнего, сушат прокаленным поташом и очищают перегонкой; γ-Л. получаются, кроме того, превращением изомерных им непредельных кислот, у которых двойная связь находится между β- и γ- или γ- и δ-углеродными атомами. Такое превращение названных кислот происходит при нагревании их в водных растворах с разбавленной серной кислотой, при присоединении к ним бромистого водорода и обратном отщеплении его (с помощью нейтрализации полученных γ-бромокислот углекислыми щелочами или кипячения их с водой), или даже просто при перегонке, например:  [5] О частном случае получения бутиролактона из хлористого сукцинила упомянуто выше. Состав Л., отвечающих предельным двухатомно-одноосновным оксикислотам, выражается общей формулой CnH2n−2O2. Они вообще представляют тела нейтрального характера. γ-Л. суть бесцветные жидкости или легкоплавкие кристаллические вещества со слабым запахом, летучие с парами воды, а также и сами по себе перегоняющиеся без разложения. Они растворимы в воде, причем растворимость уменьшается с возрастанием частичного веса (первые два члена ряда бутиро-Л. и валеро-Л. растворимы во всех пропорциях). Растворимость Л. в воде при нагревании в начале уменьшается, а затем вновь возрастает при дальнейшем повышении температуры. Вследствие этой особенности насыщенные на холоде растворы их при умеренном нагревании мутятся от выделения части растворенного Л., а затем выше 80° снова становятся прозрачными. Из водных растворов Л. выделяются поташом. Вода при кипячении отчасти переводит их обратно в оксикислоты и приобретает вследствие этого кислую реакцию. Предел гидратации наступает, напр., для γ-валеро-Л. уже по превращении всего лишь 6,6% взятого его количества (Henry). Присутствие малой примеси соляной кислоты, по-видимому, совершенно препятствует такому превращению. Оно идет до конца при кипячении Л. с углекислыми щелочами (медленно) или с едким баритом (быстро), причем образуются соответствующие соли оксикислот. Водный аммиак превращает γ-Л. в амиды γ-оксикислот, например:
[5] О частном случае получения бутиролактона из хлористого сукцинила упомянуто выше. Состав Л., отвечающих предельным двухатомно-одноосновным оксикислотам, выражается общей формулой CnH2n−2O2. Они вообще представляют тела нейтрального характера. γ-Л. суть бесцветные жидкости или легкоплавкие кристаллические вещества со слабым запахом, летучие с парами воды, а также и сами по себе перегоняющиеся без разложения. Они растворимы в воде, причем растворимость уменьшается с возрастанием частичного веса (первые два члена ряда бутиро-Л. и валеро-Л. растворимы во всех пропорциях). Растворимость Л. в воде при нагревании в начале уменьшается, а затем вновь возрастает при дальнейшем повышении температуры. Вследствие этой особенности насыщенные на холоде растворы их при умеренном нагревании мутятся от выделения части растворенного Л., а затем выше 80° снова становятся прозрачными. Из водных растворов Л. выделяются поташом. Вода при кипячении отчасти переводит их обратно в оксикислоты и приобретает вследствие этого кислую реакцию. Предел гидратации наступает, напр., для γ-валеро-Л. уже по превращении всего лишь 6,6% взятого его количества (Henry). Присутствие малой примеси соляной кислоты, по-видимому, совершенно препятствует такому превращению. Оно идет до конца при кипячении Л. с углекислыми щелочами (медленно) или с едким баритом (быстро), причем образуются соответствующие соли оксикислот. Водный аммиак превращает γ-Л. в амиды γ-оксикислот, например:
При действии металлического натрия или этилата натрия они дают растворимые в воде натриевые производные, которые под влиянием соляной кислоты превращаются в продукты уплотнения, образованные двумя частицами Л. с выделением одного пая воды (см. Оксетоны). Число известных γ-Л. довольно значительно (до С10), причем для многих получено по несколько изомеров. Простейший из γ-Л., бутиро-Л. C4H6O2, застывает при −42°, кипит при 204°, удельный вес 1,129 (16°), хорошо растворим в спирте и эфире, хромовой смесью или азотной кислотой окисляется в янтарную кислоту, восстанавливает серебряные растворы с выделением металлического серебра в виде зеркала и с окисью серебра частью переходит в янтарно-серебряную соль (Зайцев). γ-валеро-Л. C5H8O2 (норм.) застывает при −31°, кипит при 206—207°, удельный вес 1,072 (0°), находится в виде примеси в древесном уксусе, дает при окислении слабой HNO3 янтарную кислоту. Строение этих Л. дано выше. Из γ-капро-Л. С6H10O2 укажем на норм. (γ-этилбутиро-Л.), кипящий при 220°, и γ2-диметилбутиро-Л. (изокапро-Л.), получаемый изомеризацией пиротеребиновой кислоты и окислением изобутилуксусной, плавящийся при +7—8°, кипящий при 206—207° и растворимый при 0° в 2 объемах воды. Из γ-гепта-Л. С7H12O2, полученный из теракриловой кислоты, плавится уже при +11° и растворяется в 12 объемах воды при 0°. δ-Л. по своим свойствам и превращениям вообще сходны с вышеописанными. δ-Капро-Л. (норм.)  представляет бесцветную, слабого ароматического запаха жидкость, кипящую при 230—231°, застывающую на холоде в длинные иглы, плавящиеся при +17—19°, и растворимую в воде во всех пропорциях.
представляет бесцветную, слабого ароматического запаха жидкость, кипящую при 230—231°, застывающую на холоде в длинные иглы, плавящиеся при +17—19°, и растворимую в воде во всех пропорциях.
Непредельные Л. При медленной перегонке левулиновой кислоты C5H8O3 (см.), через потерю ею частицы воды, образуются два изомерных непредельных, по своим свойствам сходных с Л., вещества состава С5H6O2, из которых одно кристаллично(т. пл. +18°), другое — жидко. Рассматривая левулиновую кисл. как окси-Л. (см. ниже)  , следует и эти вещества признать: первое (ангелика-Л.) — за Л. γ-оксиэтилиденпропионовой кислоты
, следует и эти вещества признать: первое (ангелика-Л.) — за Л. γ-оксиэтилиденпропионовой кислоты  и второе (изоангелика-Л.) — за Л. γ-оксиаллилуксусной кислоты
и второе (изоангелика-Л.) — за Л. γ-оксиаллилуксусной кислоты ![]() . Относительно α-пирона, представляющего по форме δ-Л. кислоты СН(ОН):СН.CH:СН.СОНО — см. Пирон. Непредельные ароматические Л. известны троякого рода: 1) отвечающие ароматическим оксикислотам (спиртокислотам), у которых карбоксил COHO замещает водород бензольного ядра, а гидроксил ОН входит в состав жирного остатка (боковой цепи), 2) отвечающие кислотам, у которых и ОН, и СОНО входят в состав жирного остатка, и 3) отвечающие фенолокислотам с карбоксилом в составе боковой цепи. Л., отвечающих фенолокислотам, содержащим и водный остаток и карбоксил в бензольном ядре, с точностью не известно. Из первых укажем на фталид
. Относительно α-пирона, представляющего по форме δ-Л. кислоты СН(ОН):СН.CH:СН.СОНО — см. Пирон. Непредельные ароматические Л. известны троякого рода: 1) отвечающие ароматическим оксикислотам (спиртокислотам), у которых карбоксил COHO замещает водород бензольного ядра, а гидроксил ОН входит в состав жирного остатка (боковой цепи), 2) отвечающие кислотам, у которых и ОН, и СОНО входят в состав жирного остатка, и 3) отвечающие фенолокислотам с карбоксилом в составе боковой цепи. Л., отвечающих фенолокислотам, содержащим и водный остаток и карбоксил в бензольном ядре, с точностью не известно. Из первых укажем на фталид  , представляющий Л. (именно γ-Л.) ортооксиметилбензойной кислоты COHO.C6H4.CH2(OH). Фталид получается аналогично бутиро-Л. из хлористого фталила C6H4(COCl)2 при восстановлении его цинком с соляной кислотой, кристаллизуется в иглах, и плавящихся при 73°; кипит он при 282° — 290°, трудно растворим в воде, легко в спирте,при кипячении с едким натром переходитв соль ортооксиметилбензойной кислоты, приокислении дает фталевую кислоту. Представителями вторых служит фенилбутиро-Л. (γ)
, представляющий Л. (именно γ-Л.) ортооксиметилбензойной кислоты COHO.C6H4.CH2(OH). Фталид получается аналогично бутиро-Л. из хлористого фталила C6H4(COCl)2 при восстановлении его цинком с соляной кислотой, кристаллизуется в иглах, и плавящихся при 73°; кипит он при 282° — 290°, трудно растворим в воде, легко в спирте,при кипячении с едким натром переходитв соль ортооксиметилбензойной кислоты, приокислении дает фталевую кислоту. Представителями вторых служит фенилбутиро-Л. (γ)  (темп. плавл. 37°, темп. кип. 306°), отвечающий γ-фенил-γ-оксимасляной кислоте C6H5CH(OH).CH2.CH2COHO и получаемый кипячением фенил-изокротоновой С10Н10О2 или фенил-параконовой С11H10О4кислот с разбавленной водой серной кислотой. К этой же группе принадлежат изомерные β-Л.:
(темп. плавл. 37°, темп. кип. 306°), отвечающий γ-фенил-γ-оксимасляной кислоте C6H5CH(OH).CH2.CH2COHO и получаемый кипячением фенил-изокротоновой С10Н10О2 или фенил-параконовой С11H10О4кислот с разбавленной водой серной кислотой. К этой же группе принадлежат изомерные β-Л.:  , отвечающие орто-, мета- и паранитрофенил-β-молочным кислотам и получаемые при действии соды в водном растворе на орто-, мета- и паранитрофенил-β-бромпропионовые кислоты. Они представляют кристаллические вещества и со щелочами легко переходят в соответствующие оксикислоты. Из числа ароматических Л., относящихся к третьей группе, более известны δ-Л. Таковы: ангидрид мелилотовой (ортогидрокумаровой) кислоты (см.), гидрокумарин
, отвечающие орто-, мета- и паранитрофенил-β-молочным кислотам и получаемые при действии соды в водном растворе на орто-, мета- и паранитрофенил-β-бромпропионовые кислоты. Они представляют кристаллические вещества и со щелочами легко переходят в соответствующие оксикислоты. Из числа ароматических Л., относящихся к третьей группе, более известны δ-Л. Таковы: ангидрид мелилотовой (ортогидрокумаровой) кислоты (см.), гидрокумарин  и еще более непредельный кумарин
и еще более непредельный кумарин  , отвечающий кислоте ортокумаровой (см. Оксикоричная кислота). Кумарин и его производные, представляя по форме δ-Л., в своих свойствах (например, по отношению к щелочам) представляют некоторые существенные отличия от прочих Л.
, отвечающий кислоте ортокумаровой (см. Оксикоричная кислота). Кумарин и его производные, представляя по форме δ-Л., в своих свойствах (например, по отношению к щелочам) представляют некоторые существенные отличия от прочих Л.
Оксилактоны. Подобно двуатомным и многоатомно-одноосновные оксикислоты (полиоксикислоты), если содержат один из водных остатков в γ-положении, способны давать, дегидратируясь, соответствующие Л., оксилактоны, заключающие в своем составе одну или более групп ОН [6]. Напр., γ-δ-диоксивалериановой кисл. CH2(OH).CH(OH).CH2.CH2.COHO отвечает δ-окси-γ-валеро-Л.
Особенно многочисленные представители этого рода соединений отвечают одноосновным полиоксикислотам так. наз. «сахарной группы», представляющим продукты окисления алдоз путем превращении альдегидного остатка СОН в карбоксил СОНО (кислоты пентоновые, гексоновые, гептоновые и т. д., см. Глюкозы, Оксикислоты). Окси-Л. играли важную роль в истории изучения и синтеза глюкоз, ибо с одной стороны они обладают гораздо большей способностью к кристаллизации, сравнительно с соответственными кислотами, а с другой — самая способность этих кислот к восстановлению (амальгамой натрия) с образованием глюкоз находится в связи со способностью их давать Л. (окси-Л.), иначе говоря, кислоты восстанавливаются, лишь находясь в форме Л. или в условиях, благоприятствующих образованию последних (см. Глюкозы). Как на пример сюда относящихся окси-Л., укажем на сахарин[7]:
представляющий γ-Л. сахариновой кислоты СН2(ОН).СН(ОН).СН(ОН).С(ОН)(COHO).CH3 и получаемый при кипячении или выпаривании ее водного раствора. Он является в форме крупных кристаллов горького вкуса, плавящихся при 161°, способных возгоняться и растворимых в 8 частях воды; с водой при кипячении или при стоянии он переходит частью обратно в сахариновую кислоту. Относительно других подобных окси-Л. см. Глюкозы. Из непредельных окси-Л. известны принадлежащие к ароматическому ряду и отвечающие многоатомным спиртофенолокислотам. Таковы γ-окси Л.: фенолфталеин ![]() , отвечающий кислоте COHO.C6H4.C(OH)(C6H4.OH)2, флуоресцеин (см.) и др. Сюда же относится δ-окси Л., дафнетин (диоксикумарин)
, отвечающий кислоте COHO.C6H4.C(OH)(C6H4.OH)2, флуоресцеин (см.) и др. Сюда же относится δ-окси Л., дафнетин (диоксикумарин) ![]() и нек. др.
и нек. др.
Лактонокислоты происходят из многоосновных монооксикислот; именно, n-основные оксикислоты дают (п−1) — основные Л.-кислоты, напр. двуосновные дают одноосновные и т. д., причем выделение воды является возможным, если алкогольный водный остаток находится в γ-положении по отношению к которому-либо из карбоксилов. Одноосновные Л.-кислоты известны для оксикислот, отвечающих гомологам как малоновой (α-карбо-Л.-кислоты), так и янтарной (β-карбо-Л.-кисл.), а также для оксиглутаровой и ее гомологов (γ-карбо-Л.-кисл.). Простейшим представителем первых является α-карбо-бутиро-Л.-кислота C4H5O2(COHO), отвечающая оксиэтилмалоновой СН2(НО).СН2.CH(СОНО)2 и получаемая кратким кипячением водного раствора бромэтилмалоновой кислоты[8]:
или изомеризацией винаконовой кислоты при нагревании ее со слабой серной кислотой. α-Карбо-валеро-Л. кисл. С5H7O2(СОНО) отвечает оксипропилмалоновой CH3.CH(HO).CH3.CH(COHO)2 и. получается (ср. выше γ-Л.) при действии бромистого водорода на аллилмалоновую кислоту:
Обе кислоты представляют растворимые в воде жидкости, при нагревании переходят, отщепляя углекислоту, в γ-Л., а при кипячении с едким баритом в соли соответственных оксиалкилмалоновых кислот, которые в свободном состоянии при кипячении с водой, теряя Н2O, дают обратно Л.-кислоты. Простейшая β-карбо-Л.-кислота есть кислота параконовая ![]() , отвечающая итамалевой (оксиметилянтарной) кислоте СН2(OH).CH(СОНО)CH2.СОНО, из которой и получается через потерю воды непосредственно при выделении ее в свободном состоянии из ее солей. Проще всего ее получать кипячением с водой итабромпировинной кислоты СН2Br.CH(СОНО).СН2.СОНО (отщепляется HBr, ср. выше). Параконовая кислота кристаллична, плавится при 57°, на воздухе расплывается, при перегонке теряет, главным образом, не углекислоту, а воду и превращается в цитраконовый ангидрид. Из гомологов параконовой кислоты назовем теребиновую (γ-диметилпараконовую)
, отвечающая итамалевой (оксиметилянтарной) кислоте СН2(OH).CH(СОНО)CH2.СОНО, из которой и получается через потерю воды непосредственно при выделении ее в свободном состоянии из ее солей. Проще всего ее получать кипячением с водой итабромпировинной кислоты СН2Br.CH(СОНО).СН2.СОНО (отщепляется HBr, ср. выше). Параконовая кислота кристаллична, плавится при 57°, на воздухе расплывается, при перегонке теряет, главным образом, не углекислоту, а воду и превращается в цитраконовый ангидрид. Из гомологов параконовой кислоты назовем теребиновую (γ-диметилпараконовую)  , получаемую в виде крупных кристаллов (темп. плав. 175°) при окислении скипидара азотной кислотой и дающую при перегонке пиротеребиновую кислоту, и β-карбокапролактоновую
, получаемую в виде крупных кристаллов (темп. плав. 175°) при окислении скипидара азотной кислотой и дающую при перегонке пиротеребиновую кислоту, и β-карбокапролактоновую  (темп. плав. 68—69°), получаемую изомеризацией аллилянтарной кислоты под влиянием бромистого водорода (ср. выше) и отличающуюся от предыдущих своей способностью перегоняться (при 260°) почти без разложения. Из Л.-кислот, отвечающих ряду оксиглутаровой, укажем лишь на γ-карбобутиро-Л. кислоту
(темп. плав. 68—69°), получаемую изомеризацией аллилянтарной кислоты под влиянием бромистого водорода (ср. выше) и отличающуюся от предыдущих своей способностью перегоняться (при 260°) почти без разложения. Из Л.-кислот, отвечающих ряду оксиглутаровой, укажем лишь на γ-карбобутиро-Л. кислоту  (темп. плав. 49—50°), с большой легкостью образующуюсяиз α-оксиглутаровой и при восстановлении йодистым водородом дающую глутаровую. Пример двуосновной Л.-кислоты представляет лактоизолимонная кислота
(темп. плав. 49—50°), с большой легкостью образующуюсяиз α-оксиглутаровой и при восстановлении йодистым водородом дающую глутаровую. Пример двуосновной Л.-кислоты представляет лактоизолимонная кислота  , отвечающая изолимонной СОНО.CH(ОН).CH(СОНО).СН2.СОНО [9]. Известны также Л.-кислоты ароматического ряда, отвечающие фталиду и кумарину, например фталидкарбоновая кислота
, отвечающая изолимонной СОНО.CH(ОН).CH(СОНО).СН2.СОНО [9]. Известны также Л.-кислоты ароматического ряда, отвечающие фталиду и кумарину, например фталидкарбоновая кислота  и кумаринкарбоновая кислота
и кумаринкарбоновая кислота  и др.
и др.
Дилактоны. Двуосновные диоксикислоты, заключая в своем составе 2 карбоксила и 2 водных остатка, способны дважды претерпевать выделение воды по типу Л. Выделяя одну частицу воды, они будут давать место образованию окси-Л. кислот, а при выделении 2 частиц дадут ди-Л. Так, один из 2 стереоизомеров симм. диметилдиоксиглутаровой кисл. COHO.C(CHЗ)(OH).CH2.C(CH3)(OH).COHO с большой легкостью переходит в окси-Л. кислоту  c темп. плав. 188—190°, а эта последняя при перегонке дает ди-Л.
c темп. плав. 188—190°, а эта последняя при перегонке дает ди-Л.  , который плавится при 104—105° и почти не растворим в холодной воде. Подобным же образом диоксидипропилмалоновой кислоте
, который плавится при 104—105° и почти не растворим в холодной воде. Подобным же образом диоксидипропилмалоновой кислоте  отвечает ноноди-Л.
отвечает ноноди-Л.  , получаемый при действии бромистого водорода на диаллилмалоновую кислоту, плавящийся при 105—106°, кипящий без разложения выше 360°, также почти не растворимый в холодной воде, но легко растворимый в горячей. Аналогичные соединения известны и для двуосновных полиоксикислот сахарной группы, как, например, ди-Л.(собств. диоксиди-Л.)
, получаемый при действии бромистого водорода на диаллилмалоновую кислоту, плавящийся при 105—106°, кипящий без разложения выше 360°, также почти не растворимый в холодной воде, но легко растворимый в горячей. Аналогичные соединения известны и для двуосновных полиоксикислот сахарной группы, как, например, ди-Л.(собств. диоксиди-Л.)  , отвечающие оптически изомерным d, l, i манносахарным кислотам и др. Примечательно, что сахарные кислоты менее, по-видимому, склонны к образованию Л., а для слизевых последние и вовсе не получены. Относительно Л., отвечающего глюкуроновой кислоте (альдегидоксикислоте), см. Глюкуроновая кислота.
, отвечающие оптически изомерным d, l, i манносахарным кислотам и др. Примечательно, что сахарные кислоты менее, по-видимому, склонны к образованию Л., а для слизевых последние и вовсе не получены. Относительно Л., отвечающего глюкуроновой кислоте (альдегидоксикислоте), см. Глюкуроновая кислота.
Примечания
править- ↑ Настоящих кислотных ангидридов оксикислоты, как известно, не образуют.
- ↑ Простейший представитель Л. — бутиролактон С4H6O2 был открыт Зайцевым (1873), получившим его при восстановлении хлористого сукцинила С2H4(COCl)2 амальгамой натрия, но по сходству некоторых превращений (см. ниже) принявшим его за изомерный ему янтарный альдегид С2 H4 (СОН)2.
- ↑ Исключения встречаются лишь при ароматических оксикислотах (см. ниже).
- ↑ О получении их — см. Оксикислоты.
- ↑ Правильная формула γ-валеролактона:
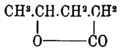 (см. Поправки и дополнения к т. XXI. — Прим. ред.).
(см. Поправки и дополнения к т. XXI. — Прим. ред.).
- ↑ Окси-δ-Л., т. е. таких, при образовании которых в лактонном выделении воды принимал бы участие водный остаток, находящийся в δ-положении по отношению к карбоксилу, в ряду предельных соединений неизвестно.
- ↑ Не следует смешивать его с веществом ароматического ряда, применяемым вследствие сладкого вкуса в качестве суррогата сахара и тоже называемым (неправильно) сахарином.
- ↑ Получается из непредельной виниконовой (триметилендинарбоновой) кислоты
- ↑ Сама лимонная кислота COHO.CH2.C(OH)(COHO).СН2.СОНО, как не содержащая ОН в γ-положении, Л. не образует.