Горчичные масла, или изородановые эфиры, RNCS (где R = СН3, C2H5 и т. д.), суть производные неизвестного в отдельности тиокарбимида HNCS, изомерного с родановой кислотой. Они являются изомерами нормальных родановых эфиров RSCN и аналогами изоциановых, с которыми имеют одинаковое строение, отличаясь по составу тем, что вместо кислорода содержат серу, и на самом деле из тех и других могут быть получены. Так, родановый аллил C3H5SCN при перегонке или при долгом хранении (Billeter, Gerlich), а родановый метил CH3NCS при продолжительном нагревании до 185° (Hofmann) превращаются в соответствующие аллиловое и метиловое Г. масла. Образование Г. масла из изоциановых эфиров происходит при нагревании последних с пятисернистым фосфором Р2S5 (Michael, Palmer) по ур.: 5RNCO + P2S5 = 5RNCS + P2O5, и состоит в замещении кислорода серою. В природе встречаются: вторичнобутиловое Г. масло ![]() в эфирном масле ложечной травы (Cochlearia offïcinalis) и аллиловое Г. масло C3H5-NCS главным образом в семенах черной и белой (сарептской) горчицы (Sinapis nigra, juncea), откуда произошло и название Г. масла для этой группы соединений, а также в хрене и некоторых других. C3H5-NCS находится в горчице в форме калийной соли особого глюкозида, называемого мироновой кислотой, C10H18NS2O10K, распадающейся в водном растворе под влиянием неорганизованного фермента мирозина (также находится в семенах Г.) по уравн.: C10H18NS2O10K = C3H5NCS + C6H12O6 + KHSO4 (мироновая кислота = аллиловое Г. масло + глюкоза + кислая серно-калиевая соль). Все Г. масла, за исключением метилового CH3-NCS, который тверд и кристалличен, представляют жидкости. Они мало или совсем нерастворимы в воде, кипят выше 100° и даже 200° (ароматич. и высшие гомологи из жирных), обладают едким, раздражающим слизистые оболочки и вызывающим слезы запахом (запах горчицы, хрена, редьки) и сильно действуют на кожу. Последние свойства обусловливают применение горчицы как вкусового вещества и в медицине. Свойства и превращения Г. масла изучены благодаря, главным образом, классическим исследованиям Гофмана, который дал и общие способы их получения. Г. масла жирного ряда получаются сухой перегонкой солей первичных аминов и алкилированных дитиокарбаминовых кислот [1] с хлорной ртутью или, что лучше, действуя на них йодом в спиртовом растворе, а ароматические — при перегонке двузамещенных тиомочевин [2] с фосфорным ангидридом или при нагревании их с крепкой соляной кислотой в запаянной трубке (Weith, Merz). Реакции протекают по след. уравн. для жирного Г. масла (R = СН3, C2H5 и т. д.)
в эфирном масле ложечной травы (Cochlearia offïcinalis) и аллиловое Г. масло C3H5-NCS главным образом в семенах черной и белой (сарептской) горчицы (Sinapis nigra, juncea), откуда произошло и название Г. масла для этой группы соединений, а также в хрене и некоторых других. C3H5-NCS находится в горчице в форме калийной соли особого глюкозида, называемого мироновой кислотой, C10H18NS2O10K, распадающейся в водном растворе под влиянием неорганизованного фермента мирозина (также находится в семенах Г.) по уравн.: C10H18NS2O10K = C3H5NCS + C6H12O6 + KHSO4 (мироновая кислота = аллиловое Г. масло + глюкоза + кислая серно-калиевая соль). Все Г. масла, за исключением метилового CH3-NCS, который тверд и кристалличен, представляют жидкости. Они мало или совсем нерастворимы в воде, кипят выше 100° и даже 200° (ароматич. и высшие гомологи из жирных), обладают едким, раздражающим слизистые оболочки и вызывающим слезы запахом (запах горчицы, хрена, редьки) и сильно действуют на кожу. Последние свойства обусловливают применение горчицы как вкусового вещества и в медицине. Свойства и превращения Г. масла изучены благодаря, главным образом, классическим исследованиям Гофмана, который дал и общие способы их получения. Г. масла жирного ряда получаются сухой перегонкой солей первичных аминов и алкилированных дитиокарбаминовых кислот [1] с хлорной ртутью или, что лучше, действуя на них йодом в спиртовом растворе, а ароматические — при перегонке двузамещенных тиомочевин [2] с фосфорным ангидридом или при нагревании их с крепкой соляной кислотой в запаянной трубке (Weith, Merz). Реакции протекают по след. уравн. для жирного Г. масла (R = СН3, C2H5 и т. д.)
Полученные Г. масла очищаются после высушивания фракционированной перегонкой. Кроме этих способов и случаев образования, указанных в начале статьи, следует отметить получение аллилового Г. масла из семян черной горчицы (1 килогр. дает около 7 гр.), при перегонке йодистого аллила C3H5J с роданистым калием KSCN [4], по Зинину и Бертело и де Люка (обыкновенный способ его приготовления), и при обработке сернистого аллила (C3Н5)2S (чесночное масло) роданистым калием, а также образование фенилового Г. масла C6H5-NCS соединением фенилкарбиламина C6H5-NC с серой (Weith) и при взаимодействии анилина C6H5-NH2 с хлористым тиокарбонилом CSCl (Rathke). По своим химическим превращениям Г. масла вполне аналогичны изоциановым эфирам и весьма резко отличаются от нормальных родановых эфиров. При всех реакциях их распадения углеводородный остаток R всегда выделяется в соединении с азотом в виде амина NH2R, что и определяет вышеприведенное их строение, как замещенных тиокарбимидов, и отличает от родановых эфиров, выделяющих азот (в виде NH3) отдельно от R [в виде спирта R(HO)]. Так, при нагревании с крепкой соляной кислотой в запаянной трубке или при действии крепкой серной они гидратируются (см. Гидратация), распадаясь на амин и сероокись углерода или продукты ее дальнейшего распадения по уравнениям:
RNCS + Н2O = RNH2 + CSO и
RNCS + 2Н2O = RNH2 + СО2 + Н2S;
окисляются азотною кислотою, причем сера их дает серную кислоту, а углерод угольную по ур.:
RNCS + 2О2 + 2Н2O = RNH2 + H2SO4 + СО2;
восстановление их водородом в момент выделения при действии цинка и соляной кислоты совершается с образованием тиомуравьиного альдегида по ур.:
RNCS + 2Н2 = RNH2 + CH2S.
Не менее характерны для Г. масла и реакции их соединения с аммиаком, первичными (NH2R) и вторичными (NHR2) аминами, идущие легко при обыкновенной температуре и дающие в результате одно-, двух- и трехзамещенные тиомочевины по уравнению:
a также со спиртами и меркаптанами при нагревании в запаяной трубке до 110°, причем образуются тио- и дитиокарбаминовые эфиры по уравнениям:
С сернистым водородом они, в противоположность родановым эфирам, не соединяются.
Примечания
править- ↑ Соли эти легко получаются при смешении перв. аминов с сероуглеродом в спирте или эфире:
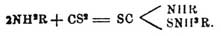
- ↑ Получаются при нагревании ароматич. первичных аминов с CS2.
- ↑ Этими реакциями пользуются для распознавания первичных аминов, так как из всех аминов только первичные способны переходить в Г. масла.
- ↑ Таким образом получены из соответствующих йодистых соединений и др. Г. масла (метиловое, этиловое, гексиловое, октиловое). Здесь сперва образуются нормальные родановые эфиры, но они частью или вполне изомеризуются.


