Нитрометр — прибор для определения азота в его кислородных соединениях и именно таких, которые при взбалтывании с крепкой серной кислотой и избытком металлической ртути весь свой азот выделяют в виде окиси азота, при чем ртуть переходит в серно-кислую закись ртути, напр.:
2HNO3 + 3H2SO4 + 3Hg2 = 2NO + 3Hg2SO4 + 4Н2O.
Сюда, например, относятся: азотная кислота, нитроза, азотноватый ангидрид, соли азотной и азотистой кислот, их эфиры, а следовательно, и нитроклетчатка, нитроглицерин, нитроманнит и приготовляемые из них взрывчатые вещества (динамиты, бездымные пороха и т. п.). Изобретенный в 1878 г. Лунге Н., благодаря простоте и скорости манипуляций, а также точности результатов, получил широкое распространение первоначально для анализа нитрозы и состоял сперва из двух трубок (фиг. 1, Лунге): измерительной а, разделенной на 1/10 кубич. см, и уравнительной b.
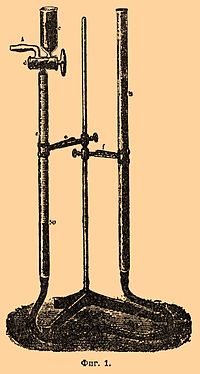
Трубка а трехходовым краном d соединяется по желанию с воронкой с или с трубкой h. Перед анализом весь прибор через b заполняется ртутью до самой воронки с. В воронку с вводится исследуемое вещество, при чем твердые вещества, которые трудно растворяются в крепкой серной кислоте, как, напр., селитра, растворяются в той же воронке в небольшом количестве воды, и раствор через кран d осторожно всасывается в трубку а. Воронка с в несколько приемов ополаскивается 5 — 10 куб. см крепкой серной кислоты, которая также вводится в а, причем наблюдают, чтобы в а не попало воздуха. Затем содержимое трубки а взбалтывают, пока не окончится выделение окиси азота (через 2 — 5 минут). Спустя некоторое время, когда газ в трубке а примет окружающую температуру, ртуть в трубках а и b приводят к одному уровню, принимая 7 мм слоя кислоты в а равным приблизительно 1 мм ртути, и отчитывают объем газа. Так как последний в условиях опыта является сухим, то отвечающий наблюденному его объему вес азота найдется по формуле: , где V — наблюденный объем газа, S — высота барометра и t — температура. По окончании анализа продукты реакции удаляются через h, прибор ополаскивается серной кислотой и затем он снова готов к употреблению. При более точных опытах обыкновенно предпочитают измерение объема окиси азота производить не в самом Н., а в измерительной трубке, как показано на фиг. 2, где изображен Н. Научно-технич. лаборатории морск. ведомства в СПб. Здесь разложение ведется в сосуде а, сосуд b служит для помещения ртути, вытесняемой при реакции из а, и для изменения давления в а. Выгода шарообразных сосудов а и b та, что они могут помещаться на штативе без винтовых зажимов в кольцах f, обтянутых резиновой трубкой для мягкости, чем значительно облегчается и ускоряется работа с нитрометром. Емкость сосуда а около 150 кубич. сантим. Наполнение сосуда а ртутью и введение в него анализируемого вещества и крепкой серной кислоты производится, как было указано выше. По окончании реакции, поднимая сосуд b, газ собирают над ртутью в трубке G [1]. При большом числе анализов, чтобы не тратить время каждый раз на очистку и подготовку измерительных трубок, на наблюдение барометра и температуры, а также и для упрощения вычисления результатов анализа, весьма удобно пользоваться для измерения газа прибором, показанным на фиг. 3.

Прибор для разложения остается тот же, что и на фиг. 2, только трубка h обрезана на месте пунктира. Трубка M (фиг. 3) служит для измерения газа; трубка О — для регулирования давления в M и N; трубку N наполняют раз навсегда таким объемом сухого воздуха (с каплей серной кислоты), который при 0° и 760 мм давления занимает объем 100 куб. см. Соединительную каучуковую трубку, трубку М, ходы крана, трубки h′ и l через О наполняют ртутью. Трубку N запирают стеклянной пробкой q, смазанной салом, заливают пробку ртутью и сверху закрывают резиновой пробкой v, которая удерживает пробку q при увеличении давления в N [2]. Когда реакция в сосуде для разложения окончится, трубки h (фиг. 2) и h′ наполненные предварительно ртутью, соединяют каучуковой смычкой, затем, увеличив давление в а (фиг. 2) и уменьшив его в M, переводят газ из а в М, пока h′ и ход крана не заполнятся кислотой. Дав охладиться газу в М, приводят ртуть в M и N к одному уровню, притом так, чтобы в N она стояла на делении 100, тогда газ в M будет в тех же условиях температуры и давления, как и в N, а в N он занимает тот объем, какой он занимал бы при нормальных условиях, стало быть, и газ в M приведен к тому объему, какой он занял бы в таких же условиях, и остается отсчитать его объем. Вычисление веса азота х по формуле: V/2×0,001256. Вместо куб. см можно отчитывать прямо миллиграммы измеряемого газа, если ртуть в трубке N поставить на деление, отвечающее весу 100 л данного газа, напр. для NO — на 134,3, и сравнивать объем газа в M уже с этим делением. Можно, наконец, установить ртуть в N и на таком делении, которое отвечает весу того вещества, количество которого желают определить в анализируемом теле; так, напр., для азотной кислоты это деление будет (134,3×63)/(30×2) = 141, и тогда каждый куб. см NO в M отвечает 2 мг HNO3. Трубка N в таких случаях имеет деления до 150 куб. см. Само собой, что такой измерительный прибор годится для всех газов, не действующих на ртуть, и для анализа смеси таких газов, причем для отвода их в поглотительные приборы служит трубка l [3]. В трубке M можно измерять и влажные газы (что бывает чаще) при сухом воздухе в N, но проще и в N иметь влажный воздух, для чего вместо капли серной кислоты ввести в N каплю воды [4].
Примечания
править- ↑ Что касается точности определения азота в виде NO в условиях, представляемых Н., то она вообще вполне удовлетворительна и не выходит из пределов требований, предъявляемых обыкновенно к хорошему способу анализа. Единственной погрешностью (именно в сторону —), но весьма незначительной, лежащей в самом методе и потому постоянной (так что ее можно принять в расчет), здесь является погрешность, происходящая от растворения окиси азота в крепкой серной кислоте. Именно, 1 к. с. последней, по Лунге, растворяет 0,000593 г NO, что при употреблении 10 — 12 к. см H2SO4 составит всего около 0,0065 г, или 0,4 к. см, и потеря, таким образом, при 100 к. см (как обыкновенно бывает) измеряемой NO не превысит 0,4% всего количества азота, что, напр. при пироксилине с 13% N в составе, дает ошибку только около 0,05%, считая на навеску. Разбавленная серная кислота, по данным Лунге, растворяет NO еще менее. Поэтому некоторые советуют, большей точности ради, употреблять, по возможности, не слишком крепкую серную кислоту или, по крайней мере, смывать более слабой кислотой. (5 об. H2SO4 + 1 об. H2О) остатки навески из сосуда с в сосуд а (фиг. 2)
- ↑ Вместо такого устройства трубку N можно закрыть краном с хорошим шлифом, или, что лучше всего, вместо крана иметь капилляр, который можно запаять.
- ↑ Изменяя соответственно сосуды для разложения и разлагающие жидкости, можно определять хлорную известь, перекиси марганца, водорода и свинца, марганцево-кислый калий, аммиачные соли и мочевину, углекислоту, углерод в железе и т. п.
- ↑ При расчете объема воздуха, который надо ввести в N при данных темп. и давл. и который в сухом состоянии при 0° в 760 мм давления занимает объем в 100 куб. см., пользуются изв. формулами: (для сухого воздуха) и (для влажного), где t — температура, Н — высота барометра и f — упругость водяного пара при t°.


