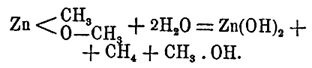Металлоорганические соединения — соединения углеводородных остатков (алкилов) с металлами; способность металлов образовать такие соединения находится в зависимости от того места, которое занимает металл в периодической системе. Д. И. Менделеев указал, что элементы, дающие М. соединения, принадлежат к четным рядам системы (см. Периодический закон). Для Fe, Mn, Ni, Со, Cr, Cu, Ag, Os не получаются М. соединения (Buckton, Carius, Wanklyn). М. соединения открыты в 1852 г. Франклэндом; трудности, представлявшиеся при их исследовании, благодаря их способности самовоспламеняться и ядовитости их паров, вполне вознаградились теоретическими следствиями их изучения. На М. соединениях было обосновано учение об атомности или валентности элементов; на них проверяли аналогию между элементами, например между С, Si, Sn и Pb и, в особенности, аналогия между элементами четвертой группы и «экасилицием» Д. И. Менделеева (впоследствии германием, открытым Кл. Винклером). Вследствие летучести М. соединений, при помощи их устанавливали атомный вес металлов. Прямым действием металлов на углеводороды М. соединения не получаются; главной реакцией их получения является взаимодействие металлов с одногалоидозамещенными углеводородами; многие М. соединения получаются действием металлов на уже готовые М. соединения других металлов. Большинство из них легко разлагается водой на водную окись металла и углеводород. Все вообще с легкостью вступают во всевозможные реакции и представляют в руках химика незаменимое средство для введения углеводородных остатков при синтезе органических соединений.
Соединения щелочных металлов. Изолировать соединения натрия и калия еще не удалось, но имеются совершенно определенные указания на их существование. Na и K растворяются в цинкорганических соединениях, выделяя эквивалентные количества цинка. Из раствора Na в цинкэтиле (Zn[C2H5]2) выделяются кристаллы состава NaC2H5+Zn(С2Н5)2, плавящиеся при 27° и при дальнейшем нагревании разлагающиеся с выделением металла. М. соединения щелочных металлов поглощают углекислоту и дают щелочные соли соответствующих карбоновых кислот, например:
CH3Na + CO2 = СН3.CO2Na.
М. соединения бериллия получаются при действии металлического бериллия на М. соединения ртути (Cahours), например бериллоэтил (температура кипения 185—188°): Be+Hg(C2H5)2=Be(C2H5)2+Hg. Они легко разлагаются водой по уравнению:
Be(C2H5)2 + 2Н2О = Be(OH)2 + 2C2H6.
Бериллопропил Be(C3Н7)2 кипит при 244—246°. Соединения магния (Hallwachs und Schafarik; Cahours) ближайшим образом не исследованы. Получаются магнийметил и магнийэтил при энергичной реакции магниевых опилок с соответствующими йодистыми алкилами; очень летучие жидкости с резким запахом, загорающиеся на воздухе и легко разлагаемые водой. Соединения цинка могут служить типичным примером металлоорганических соединений; получаются при действии йодистых алкилов на цинковые стружки. Реакция идет хорошо при нагревании в атмосфере углекислоты; цинковые опилки должны быть хорошо очищены промыванием в слабой серной кислоте; еще лучше приготовить медно-цинковую пару, т. е. покрыть цинковые стружки слоем молекулярной меди, опуская их в раствор медного купороса. Улучшает ход реакции прибавление небольших количеств натриевой амальгамы, сплава цинка с натрием, а также прибавление нескольких капель уксусного эфира. При нагревании на водяной или песчаной бане с обратно поставленным холодильником образуется сначала йодистый цинкалкил, например C2H5ZnI; это соединение при более высокой температуре разлагается по уравнению:
Цинкорганические соединения образуются также при нагревании до 180° зерненного цинка с меркурорганическими соединениями, например Hg(C3H7)2+Zn=Zn(С3Н7)2+Hg. Последний способ особенно удобен для получения соединения Zn с высшими алкилами, начиная с пропила. Цинкорганические соединения суть бесцветные сиропообразные жидкости, на воздухе немедленно воспламеняющиеся и горящие синеватым пламенем; запах их очень неприятен; ядовиты, на коже производят болезненные обжоги. Цинкметил Zn(СН3)2 — температура кипения 46°, удельный вес 1,386 при 10,5°; цинкэтил Zn(C2H5)2 — температура кипения 118°, удельный вес при 18° — 1,182; цинкпропил Zn(С3Н7)2 — температура кипения 140—150°; цинкизобутил Zn(C4H9)2 — температура кипения 165—167°; цинкизоамил Zn(C5H11)2 — температура кипения 220°, удельный вес 1,022. Действие воды уже описано; галоиды энергично реагируют и образуют соответствующие галоидные соли Zn и галоидалкилы. При медленном доступе кислорода из растворов цинкорганических соединений в индифферентных растворителях выпадают белые, кислородосодержащие осадки; так, А. М. Бутлеров получил из цинкметила соединение состава СН3.Zn.ОСН3, разлагавшееся водой на водную окись цинка, метан и метиловый спирт по уравнению:
Соединения кадмия. Кадмийэтил Cd(C2H5)2 получается аналогично цинкэтилу, но в чистом состоянии не выделен.
М. соединения ртути или меркурорганические соединения. Йодистые алкилы реагируют с металлической ртутью при обыкновенной температуре; при этом получаются соединения, подобные, например, CH3HgI; из них перегонкой с цианистым калием или еще лучше действием цинкалкилов получаются меркурдиалкилы, по уравнениям:
2HgICH3 + 2KCy = Hg(CH3)2 + 2KI + Cy2 + Hg
2HgIC2H5 + Zn(C2H5)2 = 2Hg(C2H5)2 + ZnI2.
Смешанных, т. е. содержащих разные алкилы при одном ртутном атоме, меркурдиалкилов получить не удалось; при попытках получения их возникали соединения ртути с одинаковыми алкилами, по уравнению:
2CH3HgC2H5 = Hg(CH3)2 + Hg(C2H5)2.
Меркурорганические соединения получаются при действии цинкалкилов на сулему HgCl2, причем или весь хлор замещается алкилами, или только половина его, смотря по количеству реагирующих веществ:
2HgCl2 + Zn(C2H5)2 = 2HgClC2H5 + ZnCl2
HgCl2 + Zn(C2H5)2 = Hg(C2H5)2 + ZnCl2.
Легче всего получаются меркурдиалкилы при взаимодействии йодистых алкилов со слабой натриевой амальгамой (1 часть Na на 500 частей Hg) в присутствии малых количеств уксусного эфира. Меркурдиалкилы суть бесцветные, в воде нерастворимые жидкости, которые, в противоположность цинкорганическим соединениям, постоянны на воздухе. Они обладают очень слабым запахом; более продолжительное вдыхание их производит страшно ядовитое действие. Как и цинкалкилы, меркурдиалкилы склонны легко обмениваться с другими соединениями своими алкилами, но действие их уже не так энергично; так, например:
2PCl3 + 3Zn(С2H5)2 = 2Р(С2H5)3 + 3ZnCl2
PCl3 +Hg(C2H5)2 = PCl2C2H5 + HgClC2H5.
Это делает их удобными для применения в тех синтезах органических соединений, когда цинкорганические соединения реагируют чересчур энергично. Водой не разлагаются, даже действие слабых кислот очень незначительно, но крепкие кислоты действуют с выделением соответствующих углеводородов, например:
Hg(C2H5)2 + HCl = HgC2H5Cl + C2H6
2Hg(С2H5)2 + H2SO4 = (Hg[C2H5])2SO4 + 2С2H6
Hg(CH3)2 + СН3СО2Н = HgCH3.СО2CH3 + СН4.
Хлор реагирует энергично; действие брома и йода, при условиях замедляющих реакцию, совершается по уравнению:
Hg(C2H5)2 + I2 = Hg(C2H5)I + C2H5I.
При всех вышеприведенных реакциях получаются продукты замещения одной алкильной группы галоидом; эти соединения суть кристаллические, солеобразные вещества, которые можно рассматривать как соли сложного основания, построенного по типу C2H5—Hg—OH; такие основания и получаются при взаимодействии HgAlk.Gal и окиси серебра. Основания растворимы в воде, сильнощелочные; растворы их на ощупь подобны щелоку и осаждают гидраты окисей тяжелых металлов из растворов их солей. Такие сложные основания возникают при окислении меркуралкилов марганцовокислым калием, причем один из углеводородных остатков окисляется и заменяется в М. соединениях водным остатком, а другой алкил остается неизмененным.
Соединения алюминия. При долгом настаивании йодистого этила на металлическом алюминии при повышенной температуре получается нераздельно кипящее двойное соединение йодистого алюминия с алюминийэтилом, из которого действием цинкэтила получают чистый алюминийэтил. Лучше получать это соединение при нагревании до 100—130° меркурорганических соединений с алюминиевыми стружками:
3Hg(C2H5)2 + 2Al = 3Hg + 2Al(С2H5)3.
Алюминийалкилы суть бесцветные, довольно высококипящие жидкости: Al(CH3)3 — температура кипения 127—129°; Al(C2H5)3 — температура кипения 195—200°. При соприкосновении c воздухом загораются, высшие гомологи сильно дымят, но при обыкновенной температуре не воспламеняются. С водой сильно реагируют.
Из соединений таллия получено и исследовано диалкильное соединение Tl(C2H5)Cl — шелковистые, кристаллические чешуйки, растворимые в горячей воде и спирте; обменным разложением с солями серебра получены Tl(С2Н5)2I и Tl(C2H5)2NO3; из (Tl[С2H5]2)2SO4 и Ba(ОН)2 получено основание Tl(C2H5)OH, обладающее щелочной реакцией, но не поглощающее CO2.
Соединения свинца. 1) При действии йодистых алкилов на сплавы свинца с натрием; в зависимости от количества натрия получаются то плюмбтриалкилы, например Pb2(С2Н5)3, если на 3 части Pb взята 1 часть Na, то плюмбтетралкилы, например Pb(СН3)4, если на 5 частей Pb приходится 1 часть Na; 2) при действии цинкалкилов на хлористый свинец, например:
2PbCl2 + 4Zn(C2H5)2 = 4ZnClC2H5 + Pb + Pb(C2H5)4.
Плюмбалкилы суть бесцветные жидкости со своеобразным запахом, не разлагаемые водой и в ней нерастворимые. При действии галоидов или крепких кислот переходят в солеобразные соединения, например:
Pb(СН3)4 + I2 = CH3I + Pb(СН3)3I
Pb(C2H5)4 + HCl = C2H6 + Pb(C2H5)3Cl.
Отвечающие подобным солям основания, например Pb(СН3)3ОН, обладают сильнощелочной реакцией и характерным запахом. Плюмбтетраметил Pb(СН3)4 кипит при 110°, удельный вес при 0° — 2,034; Pb(СН3)3I — длинные, бесцветные иглы, трудно растворимые в воде, легко — в спирте. При перегонке с KOH получается Pb(СН3)3ОН в виде маслянистой жидкости, пахнущей горчицей и застывающей в призматические иглы. Относительно М. соединений олова, германия, висмута, сурьмы, а также аналогичных соединений бора, кремния и мышьяка — см. эти слова, а для последнего также Какодил.