Взрывчатые вещества, будучи при обыкновенных условиях более или менее постоянны, под влиянием накаливания, удара, трения и тому под. способны «взрывать», то есть быстро разлагаться, превращаясь в накаленные сжатые газы, стремящиеся занять большой объем. Происходящие газы, встречая преграды, производят на них давление, результатом чего являются: передача части живой силы взрыва частям преграды, перелом ее и измельчение, а иногда и отбрасывание с запасом живой силы частей, оказавших наименьшее сопротивление. Таким свойством В. веществ пользуются во множестве случаев, напр. при проведении туннелей, уничтожении подводных камней, выработке рудников, для движения механизмов (газовых двигателей), бросания ракет, стрельбы, действия мин при защите берегов и т. п.
Древние народы не знали В. веществ. Изучение их, начавшееся в XV столетии благодаря открытию пороха, бывшего ранее известным в Китае, имеет значение не только потому, что они оказывают множество услуг и часто сильно облегчают работу, действуя как молот, ударом, но даже и потому, что может предотвратить получение случайных взрывов и содействовать закономерному управлению силой взрывчатых веществ.
Предлагаемая статья содержит сведения: I) о составе В. веществ; II) о разложении их при взрыве; III) о скорости взрывов; IV) о детонации; V) об объеме газов; VI) о количестве отделяющегося при взрывах тепла; VII) о температуре при взрывах; VIII) о давлениях, развиваемых В. веществами, и IX) о работе В. веществ [1].
I. Состав В. веществ. Между В. веществами известны твердые, жидкие тела и газы; напр. обыкновенный порох — твердое тело, нитроглицерин — жидкость, смесь светильного газа с воздухом — газ.
1) Если смешать между собой по возможности однородно, в известной пропорции, с одной стороны, тела, легко выделяющие при нагревании кислород, и с другой — тела горючие, способные через соединение с кислородом давать тепло и газообразные продукты, то получатся так называемые взрывчатые смеси, которые могут быть весьма разнообразны.
Простейшая из таких смесей есть гремучий газ, составленный из 2 об. водорода и 1 об. кислорода; сообщение огня какой-либо точке этой смеси вызывает почти мгновенное ее сгорание, т. е. соединение взятых тел с образованием 2 об. водяного пара и отделением огромного количества тепла. Явление взрыва, наблюдаемое при воспламенении в закрытой оболочке, обусловливается собственно отделяющимся теплом: на счет его не только распространяется горение быстро от слоя к слою, но и происходит столь сильное нагревание водяного пара, что при взрыве в закрытой оболочке на стенки ее получается давление в 10 раз большее сравнительно с начальным давлением смеси. Так же точно содержится при зажигании смесь из 2 об. окиси углерода и 1 об. кислорода: она весьма быстро и с большим отделением тепла образует 2 об. углекислого газа, если его измерять после взрыва, приведя к начальной температуре и начальному давлению, при которых измерены начальные объемы. Вместо 1 об. кислорода на 2 об. водорода или на 2 об. окиси углерода можно было бы взять 4,8 об. воздуха, т. е. смеси из 1 об. кислорода и 3,8 азота, причем рядом с продуктами горения — водой и углекислотой — получился бы свободный азот, в сущности же произошли бы те же явления, хотя и с меньшей интенсивностью, вследствие затраты тепла на нагревание азота, не принимающего участия в самом горении. Но вода и углекислота образуются при горении всяких органических веществ, как содержащих углеводородные элементы, поэтому и смеси их паров с кислородом или воздухом должны содержаться подобно предыдущим. Действительно, газообразные углеводороды, напр. светильный газ, пары летучих соединений, напр. эфира, бензина и т. п., образуют с воздухом взрывчатые системы; так назыв. рудничный газ есть не что иное, как смесь болотного газа с воздухом. Пары сернистого углерода, брызги нефти, угольная и серная пыль, крупинки крахмала и т. п., смешанные с воздухом, также могут дать место взрывам. Если прибавим, что свободный кислород во многих из таких смесей может быть заменен газообразными химическими его соединениями, легко разлагающимися, напр. закисью азота, окисью азота и т. п., то разнообразие В. смесей газов еще увеличится; так, 2 об. водорода с 2 об. закиси азота, взрываясь, превращаются в 2 об. водяного пара и 2 об. азота; или 2 об. циана с 4 об. окиси азота дают при воспламенении 4 об. углекислоты и 2 об. азота. При искусственном образовании взрывчатых смесей стремятся, чтобы взятое количество кислорода или вещества, его содержащего, было достаточно для полного сжигания горючих элементов смеси, напр. водорода и углерода. Нахождение наивыгоднейшей пропорции смешения по объему делается, изображая состав участвующих в превращении тел химическими частичными формулами, а само превращение — уравнениями, так как относительные весовые количества тел, соответствующие таким формулам, занимают в газообразном состоянии при одинаковых температуре и давлении равные объемы, а именно в 2 раза больший объем, чем объем весовой единицы водорода, по отношению к которому выражаются веса всех частиц. Тогда уравнение, взятое так, чтобы весь водород превращался в воду, углерод в углекислый газ, сера в сернистый газ и т. п., прямо укажет, в какой именно пропорции следует произвести смешение; оно в то же время дает и объем продуктов горения.
Напр.:
| СН4 | + | 2O2 | = | СО2 | + | 2H2O; |
| 2 об. болот. газ (метан) |
4 об. кисло- род |
2 об. углекис- лый газ |
4 об. водяной пар | |||
| (С2Н5)2О | + | 6О2 | = | 4СО2 | + | 5H2O; |
| 2 об. пары эфира |
12 об. кисло- род |
8 об. углекис- лый газ |
10 об. водяные пары | |||
| CS2 | + | 3О2 | = | СО2 | + | 2SO2; |
| 2 об. пары серо- углерода |
6 об. кисло- род |
2 об. углекис- лый газ |
4 об. сернистый газ |
Изображение взрывчатых превращений химическими равенствами представляет наглядно и многие другие их свойства, почему ими пользуются постоянно. Небольшое уклонение от наивыгоднейшей пропорции кислорода не уничтожает взрывчатости системы; оно только меняет состав продуктов, обусловливая появление в них или свободного кислорода (в случае его избытка), или продуктов неполного горения, напр. окиси углерода (в случае избытка горючего газа, содержащего углерод). Но, постепенно увеличивая уклонение как в одну, так и в другую сторону, мы дойдем до пределов, когда горение перестает распространяться само собой, и тогда явление взрыва не наблюдается; причина этого заключается в том, что при большом избытке одного из смешанных газов температура в слоях, окружающих место возбуждения горения, этим избытком сильно понижается и нагревание их не достигает точки воспламенения. Но все перечисленные газовые смеси не могут употребляться в роли собственно взрывчатых веществ по причине очень большого объема, занимаемого ими в обыкновенных условиях. Единственная, которая получила техническое применение, это — смесь светильного газа с воздухом, употребляемая для движения в газомоторах (см. Газовые двигатели).
Конечно, можно было бы газообразные В. смеси, способные легко принимать жидкое состояние, напр. этилен C2H4 и закись азота N2O, посредством охлаждения и давления превратить в жидкие взрывчатые смешения, занимающие малый объем и подобные настоящим взрывчатым жидкостям; но проще взять как горючие, так и поддерживающие горение вещества, имеющие это состояние в обыкновенных условиях. Останавливаясь собственно на выборе жидкостей, поддерживающих горение, обращают на себя внимание главным образом две — азотноватый ангидрид NO2, кипящий при 26°, и дымящаяся азотная кислота HNO3, кипящая при 86°. И действительно, как с первым, так и с последним сжигающим деятелем может быть приготовлен ряд взрывчатых жидких смесей через растворение в них различных горючих соединений. Смешивая сернистый углерод CS2, бензол С6Н6 и т. п. с азотноватым ангидридом, получают панкластиты, открытые Турпеном, напр.:
| CS2 | + | 3NO2 | = | СО2 | + | 2SO2 | + | 1,5N2. |
| сероугле- род |
азотнов. ангидр. |
углек. газ |
сернис. газ |
азот |
Смешения дымящейся азотной кислоты с нитробензолом С6Н5NO2 и другими подобными соединениями представляют собой так наз. кислые В. вещества Шпренгеля:
| C6H5NO2 | + | 5HNO3 | = | 6СО2 | + | 5H2O | + | 3N2. |
| нитробен- зол |
азотная кисл. |
углек. газ |
вода | азот |
При взрыве как тех, так и других имеет место не только выделение огромного количества тепла, но и большое увеличение объема системы; так, литр панкластита вышеприведенного состава весом около 1,28 кил. дает 601,6 литров газов при нормальных условиях. Но, кроме малого начального объема, эти смеси представляют преимущество, важное в технической практике, в том отношении, что могут легко приготовляться непосредственно перед самым взрывом из веществ невзрывчатых и потому безопасных при перевозке.
Представителем твердых взрывчатых смесей служит обыкновенный порох. Горючие элементы в нем сера S и уголь С; сжигающий деятель — калийная селитра KNO3. Смешение, рассчитанное на полное сгорание, отвечает частичному составу 10KNO3 + 3S + 8С. При сообщении огня селитра выделяет азот N и кислород О, оставляя окись калия К2О; сера и уголь с кислородом превращаются в серный ангидрид SO3 и углекислоту СО2; окись калия, соединяясь с ними, дает твердые труднолетучие соли — сернокислую K2SO4 и углекислую K2СО3:
Но обыкновенно приготовляются сорта пороха с меньшим содержанием селитры, так как этим способом для единицы веса удается достигнуть увеличения объема газов, развивающихся при взрыве, а равно осуществить и некоторые другие задачи, важные при употреблении для стрельбы; напр. состав (приближенный) охотничьего сорта выражается формулой 16KNO3 + 6S + 13С, артиллерийского 2KNO3 + S + 3С; причем, понятно, в вышеозначенных продуктах взрыва должны появиться также вещества, не вполне окисленные, а именно: в газообразных — окись углерода СО, а в твердых — сернистый калий K2S. Вместо калийной селитры можно взять другие азотнокислые соли, напр. NaNO3, NH4NO3, Ва(NO3)2 или бертолетову соль KClO3 и хлорно-калиевую соль KClO4. Кроме того, здесь могут применяться также марганцово-калиевая KMnO4 и двухромовокалиевая соли K2Cr2О7, перекиси и другие подобные вещества, легко выделяющие при нагревании кислород. Вместо угля (или также и серы), с другой стороны, можно употреблять различные твердые органические тела, напр. клетчатку, крахмал C6H10O5, тростниковый сахар С12Н22О11, парафин СnН2n+2, нафталин С10Н8, уксусно-натриевую соль — NaC2H3O2, синеродистые и железисто-синеродистые соли, напр. KCN, K4Fe(CN)6, Pb2Fe(CN)6, многие сернистые металлы, напр. CuS, Sb2S3 и др., так как все эти тела способны гореть в кислороде. Какую бы ни взяли смесь из перечисленных тел, везде получим в большей или меньшей мере В. вещества, потому что везде будут присутствовать тела, легко выделяющие много кислорода, и тела, дающие при своем горении газы. И в самом деле, в различное время было предложено много разнообразных смешений, подобных обыкновенному пороху, напр. саксифрагин — из Ва(NO3)2 (с незначительной примесью KNO3) и С; амидный порох — из NH4NO3, KNO3 и С; галлоксилин — из KNO3, С, древесных опилок и K4Ее(CN)6; порох Ожандра — из KClO3, K4Fe(CN)6 и C12H22O11 и т. п. Замена одних составных частей другими одинакового значения, хотя бы и в соответствующей пропорции, влечет за собой изменение в объеме газов и в количестве тепла. Возьмем, напр., вместо калийной селитры эквивалентные количества (т. е. выделяющие то же количество кислорода) других азотнокислых солей, при чем газообразные продукты взрыва получатся сходственные и при одном и том же количестве угля и серы ни объем газов, ни количество тепла приблизительно не изменятся. Но, если делать расчет на единицу веса пороха, влияние эквивалентов сжигающих деятелей тотчас выступает на первый план. Пусть замена сделана на Ba(NO3)2: так как эквивалент (частичный вес) KNO3 есть 101, а эквивалент Ва(NO3)2 (половина частичного веса) 130,5, то поэтому на одно и то же количество серы и угля для образования сходственных продуктов горения придется взять Ba(NO3)2 на 1/3 более, т е. общий вес новой смеси будет больше, а следовательно, единица веса ее даст и газов, и тепла меньше. Обратное получится при замене KNO3 на NaNO3, потому что эквивалент последней соли менее, а именно равен только 85, т. е. единица веса смеси с NaNO3 выделит и тепла, и газов больше. Пусть, далее, вместо KNO3 употреблена азотнокислая соль меди Cu(NO3)2: в то время как KNO3, NaNO3, Ba(NO3)2 превращаются при взрыве в K2O, Na2O, ВаО, образующие с СО2 и SO3 прочные соли, Cu(NO3)2 дает чистую медь, т. е. производит сжигание не только кислородом элементов азотной кислоты, но и кислородом, соединенным с самой медью; а следовательно, с KNO3 будут эквивалентны 5/12Cu(NO3)2, или эквивалент этой соли в пороховых смесях равен 78, и с рассматриваемой точки зрения она еще выгоднее, чем NaNO3. Но так как пороха с NaNO3 и Cu(NO3)2 гигроскопичны, то они и непригодны для дела.
2) Во взрывчатых смесях частицы тел горючих и тел, поддерживающих горение, существуют отдельно; оттого при образовании наиболее типических из них (газовых и твердых) обыкновенно не наблюдается никаких внешних явлений, указывающих на внутренние частичные работы; оттого же в твердых смесях, где частицы не обладают подвижностью, никогда нельзя достигнуть совершенной однородности состава. Но можно представить, что элементы горючие и сжигающий кислород (в достаточной пропорции) совмещены в одной и той же химической частице — в однородном химическом соединении; таковы, например, азотно-аммиачная соль NH4NO3, щавелевокислые соли серебра Ag2C2O4 и ртути HgC2O4, хлорнокислый СН3ClO4 и азотнокислый метил СН3NO3 и т. п. Все подобные соединения, обладая сравнительно малой устойчивостью, при сообщении огня стремятся превратиться в систему тел наиболее прочных, каковыми являются СО2, СО, H2O, HCl, N2, т. е. дают место как бы внутричастичному сгоранию, напр.:
Однородность состава обеспечивается здесь самим актом химического соединения. Нечто подобное в этом отношении может быть у взрывчатых растворов, которые потому составляют переход к настоящим взрывчатым химическим соединениям. Наибольшее число представителей рассматриваемых соединений относится к так называемым нитросочетаниям органических веществ, образующимся из элементов с выделением тепла. Как известно, многие углеродистые вещества при обработке азотной кислотой выменивают часть своего водорода на так называемую нитрогруппу (NO2). Смотря по натуре органических веществ, эта реакция ведет к образованию или азотных эфиров, или нитросоединений.
а) Азотные эфиры, получающиеся при действии азотной кислоты на алкоголи и характеризующиеся способностью разлагаться кислотами и щелочами с возрождением первоначальных веществ, суть не что иное, как алкоголи, водный водород которых вполне или отчасти замещен нитрогруппами, а именно Rn(NO2O)n, где Rn изображает сложную группу атомов, в которой могут содержаться C, H и O. Очевидно, предельное число нитрогрупп, а вместе с тем и число паев кислорода, входящих в частицу эфира, будет условливаться атомностью (числом водных групп) данного алкоголя; от количества же кислорода находится в зависимости способность к более или менее совершенному внутричастичному сгоранию. Вследствие этого взрывчатые свойства обыкновенно являются наиболее развитыми в полных азотных эфирах многоатомных алкоголей. Таковы суть: эфиры глицерина С3Н5(NO3)3 (нитроглицерин), эритрита С4Н6(NO3)4 (нитроэритрит), маннита C6H8(NO3)6 (нитроманнит), различных углеводов, а именно — молочного сахара С12Н17О6(NO3)5 (пентанитросахароза), клетчатки С12Н14О4(NO3)6 (пироксилин) и др.
б) Нитросоединения, отличающиеся от азотных эфиров по неспособности показывать чистые реакции распадения с образованием первоначальных веществ, представляются как органические вещества, в которых нитрогруппы замещают часть углеводородного водорода Rn(NO2)n. С особенной легкостью они получаются при действии азотной кислоты на тела т. н. ароматического ряда, напр. нитронафталин C10H7(NO2), бинитробензол С6Н4(NO2)2, тринитрофенол C6H2(NO2)3OH (пикриновая кислота), тринитрокрезол С6Н(СН3)(NO2)3OH и т. п.
В практике, однако, редко употребляют указанные соединения в чистом состоянии. Так, нитроглицерин применяется в технике главн. образ. в виде смесей его с кремнеземом, называемых динамитами с недеятельным поглотителем; точно так же вместо чистого пироксилина чаще всего употребляют смеси его с водой в виде прессованных шашек под именем влажного пироксилина и т. п. Примешивание инертных веществ имеет целью или умерить силу взрывчатого действия, или сообщить массе безопасность при перевозке, хранении, приготовлении зарядов и пр. Но преимущественно посредством смешения с другими телами стараются поправить состав нитрированных веществ, который обусловливается химическими законами и в то же время далеко не всегда соответствует наивыгоднейшему отношению между количествами кислорода и горючих элементов. В самом деле, в азотных эфирах углеводов, во всех ароматических нитросоединениях содержание кислорода недостаточно для полного сгорания углерода и водорода; таковые, очевидно, полезно смешивать с селитрами и другими сжигающими деятелями. Некоторые из них по недостаточности кислорода совсем даже не могут быть употребляемы без прибавления окислителей. Отсюда происходят ряды новых взрывчатых смесей, отличающихся от вышерассмотренных тем, что горючие части в них сами по себе взрывчаты: напр. смеси пироксилина с KNO3, пикриновые пороха [смеси пикриновых солей C6H2(NO2)3OM с соответственными MNO3], смеси, содержащие нитроуглеводороды [C6H4(NO2)2, C10H7(NO2) с MNO3 или HNO3] и т. п. Наоборот, в нитроглицерине, нитроманните содержится избыток кислорода; таковые полезно смешивать с горючими веществами. Во взрывчатых смесях этого рода самостоятельная взрывчатость принадлежит сжигающему деятелю; сюда относятся многие динамиты с деятельным основанием, напр. целлюлозный динамит, в котором поглотителем нитроглицерина служит древесная масса. Но, очевидно, можно осуществить и такие смеси, в которых и горючие части, и сжигающий деятель будут вещества сами по себе взрывчатые; это, напр., имеет место в так назыв. студенистом динамите, или взрывчатом желатине, где нитроглицерин сопоставлен с пироксилином, а также в смесях нитросоединений с азотно-аммиачной солью.
3) Все выше рассмотренные вещества развивают и газы и теплоту вследствие горения. Но то и другое (газы и теплота) может получиться при простом распадении некоторых соединений, вследствие чего последние также являются веществами взрывчатыми. Таковы именно различные вещества, образованные из элементов с поглощением тепла (эндотермические) при содействии посторонней энергии, доставляемой чаще всего одновременным совершением какой-либо отделяющей тепло (экзотермической) реакции. Сюда относятся многие В. вещества, весьма интересные в химическом отношении, но практическим значением не обладающие:
а) Простейшие соединения азота: хлористый азот NCl3, йодистый азот NHJ2, азотистая ртуть N2Hg3, сернистый азот NS и др.
б) Окислы хлора — хлорноватистый ангидрид Cl2О, хлорноватая окись ClO2 и др.
в) Некоторые соединения, разлагающиеся со взрывом с помощью небольшого количества воспламененной гремучей ртути, — ацетилен С2Н2, циан С2N2, окись азота NO, сернистый углерод CS2 и др.
г) Диазосоединения, получающиеся при действии азотистой кислоты на разнообразные амидосоединения ароматического ряда.
Сообщение огня приведенным соединениям производит простое распадение их на первоначальные элементы и освобождение тепла, поглощенного при их образовании. Так, хлористый азот (жидкость уд. в. 1,65), разлагается по уравнению:
и граммовая частица его (частичный вес, выраженный в граммах), равная 120,5 граммам, выделяет при этом 57,8 больших калорий, или 57800 малых калорий (Сен-Клер-Девилль и Готфейль «An. de Chim. et de Phys.», т. LXIX, p. 152).
Явления поглощения тепла играют существенную роль и в вышерассмотренных нитрированных веществах. Легкая разлагаемость азотной кислоты и сильное сжигательное действие ее на углеродистые водороды зависят именно от того, что все кислородные соединения азота представляют собой соединения (эндотермические), образованные с поглощением тепла.
4) Наконец, ныне известны многие такие химические соединения, при взрыве которых будут иметь место одновременно оба выше установленных фактора взрывчатости: и распадение с освобождением поглощенной при их образовании энергии, и внутричастичное горение. Таковы, например, соли диазобензола — азотнокислая C6H5N2NO3, хромовокислая (С6Н5N2)2CrO4, гремучекислые соли ртути С2HgN2О2, серебра C2Ag2N2O2 и друг., так как при взрыве их углерод вполне или отчасти сгорает в окись углерода и в то же время все они образованы с поглощением тепла, ибо, относя теплоты образования из элементов к граммовым частицам, обозначая поглощение его знаком минус и выражая количества его в больших калориях (Кал.), Бертело и Вейль («Sur la forée des matières explosives d’après la Thermochimie» par Berthelot, т. II, p. 256 et 260) нашли: для гремучей ртути (284 грам.) — 62,9 Кал., для азотнокислого диазобензола (167 грам.) — 47,4 Кал.
Таким образом, область В. веществ является довольно широкой. Их можно разделить на следующие группы:
Группа I. Взрывчатые смеси, составленные из горючих и сжигающих веществ, самих по себе в отдельности не взрывчатых, а именно:
1-я подгруппа — газовые взрывчатые смеси.
2-я подгруппа — взрывчатые растворы.
3-я подгруппа — пороховые смеси (твердые), распределяющиеся, в свою очередь, по семействам соответственно натуре сжигающего деятеля.
Группа II. Азотные эфиры:
1-я подгруппа — эфиры многоатомных алкоголей и их смеси. Относящиеся сюда нитроглицериновые препараты размещаются в семейства: а) динамиты с недеятельным основанием, б) динамиты с деятельным основанием, в) взрывчатые желатины.
2-я подгруппа — эфиры углеводов, из которых пироксилин с различными препаратами, его содержащими, образует отдельное семейство.
Группа III. Нитросоединения: а) чистые (не смешанные с окислителями), напр. пикриновая кислота; б) смеси их с различными сжигающими деятелями, напр. пикриновые пороха, смеси нитроуглеводородов с NH4NO3 и др.
Группа IV. Гремучие соли.
Группа V. Взрывчатые диазосоединения.
Группа VI. В. вещества, не содержащие в себе углерода: NH4NO3, NCl3, NHJ2 и др.
Но далеко не все вещества, обладающие взрывчатостью, могут применяться в технике. Практика пользуется только такими из них, которых ценность сравнительно невелика, постоянство (неизменность) при хранении в разных климатах обеспечено, практическое получение не связано с затруднениями и опасностями. Столь же важны, кроме того, еще следующие условия: устойчивость при ударе, трении, сотрясении и тому подобных влияниях, могущих иметь место во время перевозки и употребления, способность взрывать, притом без отказа, только при определенном способе воспламенения и неуклонность в величине и характере взрывчатого действия. Пригодные для практического употребления В. вещества относятся главным образом к первым трем группам и отчасти к четвертой. В настоящее время преобладающее значение сосредоточивается особенно на порохе, нитроглицерине, динамитах и пироксилине (в различных его препаратах). Благодаря силе В. В. из нитроглицерина и пироксилина они вытесняют обыкновенный порох при производстве разнообразных взрывных работ. Порох продолжает еще держаться для производства метательных действий, но новейшие исследования, приведшие к открытию бездымного пороха, позволяют заключить, что и в этой области применений нитроглицерин и пироксилин в ближайшем будущем займут первенствующее место.
II. Разложение В. веществ. Состав и тепловые явления при образовании из элементов, определяя взрывчатые свойства, не дают еще полных основ для более точной характеристики В. веществ; для этого необходимо знать также состав и тепловые явления при образовании продуктов взрыва, другими словами — должны быть известны уравнения их разложения. Обыкновенно для возбуждения разложения В. вещество (или некоторая его доля) должно быть нагрето до определенной температуры, которая называется температурой его воспламенения, напр. обыкновенный порох — до 270°, пироксилин и нитроглицерин — до 180° и пр. В действительности, однако, такие температуры представляют величины изменчивые в зависимости от быстроты нагревания; вообще же говоря, это — такие температуры, при которых происходит химическое превращение В. веществ в газы, составляющее сущность взрывов. Согласно разнообразным исследованиям, сюда относящимся, В. вещества вообще способны разлагаться по различным уравнениям в зависимости от условий возбуждения разложения. Первым В. веществом, хорошо исследованным в указанном отношении, был обыкновенный (черный, дымный) порох. Образцовое исследование его начато было Бунзеном с Шишковым и завершено Абелем и Ноблем. Но так как это есть механическая смесь, то здесь дело очень сложно и изменчиво. Поучительнее определенные В. вещества. Типическим примером может служить азотно-аммиачная соль H4NO3, которая, по Бертело, смотря по быстроте и степени нагревания, разлагается по крайней мере по 5 различным уравнениям, то с поглощением, то с большим или меньшим отделением тепла («An. de Chimie et de Phys.», 4-e série, t. XVIII, p. 68), а именно — считая все продукты разложения газообразными, а взятую соль твердой, относя теплоты разложения к граммовой частице (80 грам.) и обозначая выделение тепла (в отличие от поглощения) знаком плюс, могут иметь место следующие превращения:
| NH4NO3 | = | HNO3 + NH3 | − | 41,3 | Кал. |
| = | N2O + 2H2O | + | 10,2 | ||
| = | 0,5N2 + NO + 2Н2О | + | 9,2 | ||
| = | 0,75N2 + 0,5NO2 + 2Н2О | + | 29,5 | ||
| = | N2 + О2 + 2H2O | + | 30,7 |
Первые три реакции происходят постепенно при осторожном нагревании соли до плавления и выше; из них преобладающая, по которой главным образом совершается разложение в этих условиях, есть вторая, т. е. та, которая применяется в лабораториях для получения закиси азота. Пятое уравнение, а также отчасти и четвертое соответствуют взрывчатому разложению, имеющему место при быстром и сильном нагревании, напр. при бросании нескольких кристалликов соли в докрасна накаленную стеклянную трубку. Подобную способность к разнообразному разложению В. вещества проявляют особенно вследствие неодинаковости местных условий, получающихся в массе, подвергнутой прогрессивному нагреванию, напр. в парафиновой ванне. Эти условия могут быть: или химические, напр. неоднородность смешения, изменение вещества предварительным менее значительным нагреванием; или физические, напр. температура, охлаждающие влияния, конденсация, испарение; или, наконец, механические, напр. давление, сотрясение и т. п. Такая же неодинаковость местных условий получается и при воспламенении В. веществ с помощью обыкновенных способов (см. Запалы), под малыми давлениями. Но если взятое вещество химически однородно по всей массе, как, напр., нитроглицерин, пироксилин, гремучая ртуть, если оно каким-либо способом сразу подвергнуто одинаковым условиям наиболее сильного нагревания во всех своих частях, то взрыв его дает продукты простые, наиболее прочные, и все разложение легко выражается одним уравнением. Такая простота разложения взрывчатых химических соединений замечается или при воспламенении их в прочных бомбах под высокими давлениями, или при взрывании с помощью капсюля с гремучей ртутью, вызывающего своим взрывом однообразные частичные расположения и состояния заряда. Только уравнения подобных правильных разложений является возможным предвидеть в настоящее время благодаря исследованиям Бертело, Сарро и Вьейля («Mémoriales des poudres et salpêtres», t. I. et II). Но дадим сначала краткое описание употребленных ими приборов.
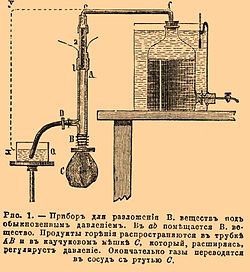
Для изучения разложений под давлениями, близкими к атмосферному, вещество (около 1 грамма) помещается в маленькую трубочку a b (см. рис. 1) около 50 мм длиной и 4 мм в диаметре, верхняя часть ее посредством каучуковой смычки е и стеклянной трубки f соединяется с бутылью, наполненной ртутью, а нижняя часть сообщается с каучуковым шаром C с помощью более широкой трубки AB (около 150 мм длиной), снабженной боковым каучуковым рукавом с зажимом D. Поместив зажимы в е и D, производят накаливание проволоки током в нижней части заряда; очевидно, что тогда разложение совершится, благодаря эластичности каучукового шара, под давлением, близким к атмосферному. Образующиеся газы переводятся в сосуд со ртутью, выпуская последнюю из крана и под конец погружая открытый конец каучукового рукава в чашку с водой, для того чтобы вытеснить остаток газов. Анализ газов, в этих условиях получающихся, и привел к вышеуказанному заключению о разнообразии и сложности их состава. Вследствие местных охлаждений реакции не доходят до конца, и получаются продукты, способные еще к дальнейшему взаимодействию с отделением значительных количеств тепла. Так, для нитроглицерина (в динамите) найдены были CO2, СО, Н2, СН4, N2 и NO; для пироксилина — СО2, СО, Н2, СН4, N2, NO; для смеси пироксилина с азотно-аммиачной солью в пропорции для полного горения — СО2, СО, Н2, N2, NO. Количества окиси азота во всех случаях получились большие, а следовательно, много кислорода действительно осталось не употребленным на горение.
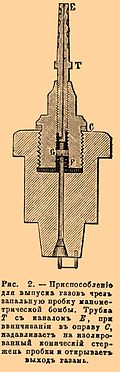
Для исследования разложений под высокими давлениями служили бомбы, употребляемые для определения количеств отделяющегося при взрыве тепла (калориметрическая) и для измерения давлений газов (манометрическая). Получающаяся при взрыве вода остается в бомбе вместе с твердыми продуктами, откуда может быть извлечена в поглотительные приборы (трубки с хлористым кальцием) и в последних дозирована. Для этого стоит только, поставив бомбу в баню при 100°, пропускать в нее воздух, вводя его по трубке, вставленной в отверстие для запального приспособления и проводя далее в поглотительные приборы. Для выпускания газов в калориметрической бомбе имеется специальный кран В с очень тонкой винтовой нарезкой снаружи и каналом по оси; нижняя коническая часть его притерта к отверстию в крышке. В манометрической бомбе выпускание газов делается с помощью особого приспособления Т, ввинчиваемого в пробку бомбы, служащую для воспламенения заряда (см. рис. 2); поворачивая стержень с каналом Е, производят нажатие на изолированный конус, который удерживается от падения посредством пружины F и гайки G так, что кругом конуса можно образовать по произволу большее или меньшее отверстие. Из бомб газы переводились в ртутный газометр емкостью около 10 литров, специально для этой цели устроенный (см. рис. 3). Он состоит из чугунной ртутной ванны А с кольцеобразным сечением, в которую погружается стеклянный колокол В, служащий собственно для собирания газов. Этот колокол двигается внутри другого стеклянного колокола C с водой, укрепленного неподвижно и снабженного вверху воронкой D. Объем газов, введенных под колокол В, измеряется количеством воды, вытекающей из боковой трубки воронки D. Движение внутреннего колокола направляется посредством скрепленного с ним железного стержня ЕЕ’, с помощью которого по произволу можно то нажимать, то приподнимать внутренний колокол и тем самым изменять давление газов. Для поднятия служит винт F в железной раме GG, расположение которой со всеми частями понятно само собой из рисунка. Введение газов производится через кран Н и каучуковую трубку I. Перед началом операции выкачиванием воздуха через Т доводят ртуть до манометра M и наполняют внешний колокол водой, пока она не начнет выливаться из D. При взрыве в прочных бомбах, как показали анализы газов, собранных описанным способом, уже не получается ни окиси азота (по крайней мере в значительном количестве), ни горючих газов при достаточном количестве кислорода, т. е. горение бывает более полным.

Для изучения продуктов взрыва, получающихся при специальном способе возбуждения разложения с помощью капсюля с гремучей ртутью, употреблялась манометрическая бомба большой емкости (320 вместо 22 куб. сант.). В центре ее подвешивался цилиндрик прессованного пироксилина в 32 гр. с капсюлем, содержащим 0,6 гр. гремучей ртути, так, чтобы заряд не касался стенок. При этом состав продуктов оказался почти тот же, как при возбуждении разложения накаленным телом при соответствующих условиях заряжания.
Обращаясь к выводам, заметим, что они, говоря вообще, оправдали правило Бертело («Mécanique chimique», par Berthelot, t. II, p. 467), по которому при воспламенении данного взрывчатого вещества сначала стремятся происходить разом, смотря по местным условиям, всякие реакции, возможные между присутствующими элементами без содействия внешней энергии, и притом каждая реакция со своей собственной скоростью. В конце некоторого короткого промежутка времени получится смесь различных соединений, относительные пропорции которых будут зависеть в особенности от этих скоростей. Если получающиеся соединения не способны реагировать друг на друга вследствие быстрого охлаждения, то все они и остаются существовать в общей смеси продуктов взрыва. Если же означенные соединения будут находиться в тесном прикосновении между собой при возвышенной температуре достаточное время, то они вступят между собой в такое взаимодействие, что окончательно получится система тел прочных, отвечающих наибольшему отделению тепла. Полученные при ближайшем изучении предмета результаты действительно подтверждают это правило: несмотря на разнообразие разложений в зависимости от местных условий, в них замечается стремление к образованию той системы продуктов, которая, будучи прочной, в то же время отделяет наибольшее количество тепла. а) Если вещество содержит в себе достаточное количество кислорода для полного сжигания горючих элементов, то получаются исключительно прочные продукты полного окисления, азот же выделяется в свободном состоянии. Так, разложение нитроглицерина точно отвечает уравнению: 2С3Н5(NO3)3 = 6CO2 + 5Н2О + 3N2 + 0,5О2. То же самое имеет место для нитроманнита С6Н8(NO3)6 и др. подобных соединений. Правило прилагается и к взрывчатым смесям, напр. к смеси пироксилина и азотно-аммиачной соли: C12H14O4(NO3)6 + 10NH4NO3 = 12CO2 + 27H2O + 13N2 + 0,5O2. Но такому именно способу разложения всех этих веществ отвечает и наибольшее количество отделяющегося тепла; при всякой другой комбинации элементов его отделилось бы меньше. Незначительные уклонения замечаются только для смесей, содержащих в себе KNO3, без сомнения — вследствие неоднородности состояния системы продуктов взрыва. б) Если же во взятом веществе содержится недостаточное количество кислорода, то ход разложения, вообще говоря, усложняется и состав продуктов изменяется отчасти с возрастанием плотности их или давления. Здесь представляются следующие случаи: случай 1-й — эндотермическое соединение содержит избыток горючих элементов, напр. гремучая ртуть, азотнокислый диазобензол. Разложение их таково: HgC2N2O2 = 2CO + N2 + Hg и 2C6H5N2NO3 = 6СО + 6С + 5Н2 + 3N2, т. е. реакции идут в сторону образования окиси углерода. Получающиеся системы тел хотя могли бы дать место дальнейшему химическому взаимодействию с отделением тепла, напр. 2СО = СО2 + С или 2СО + 2Н2 = СО2 + СН4, но, с одной стороны, эти последние реакции требуют более значительного времени, а после взрыва тотчас следует охлаждение, с другой — СО2 при возвышенной температуре есть тело непрочное, подвергающееся диссоциации с образованием СО и О, а свободный кислород тотчас окисляет накаленный уголь в СО, другими словами — система 2СО сравнительно с системой СО2 + С есть прочнейшая. Кроме того, в приведенных уравнениях пренебрежено малыми количествами побочных продуктов; так, в 100 объемах продуктов взрыва гремучей ртути содержится 0,15 об. СО2. Количество этих не вошедших в уравнение продуктов (CH4, NH3, HCN и других соединений С с H и N) для азотнокислого диазобензола достигает 9 %, что обусловливается главн. обр. влиянием водорода. Случай 2-й — количество кислорода, оставаясь недостаточным, будет больше, чем сколько нужно для превращения всего углерода в СО, и вещество представляет собой экзотермическое соединение. Сюда относятся, например, пироксилин, пикриновая кислота и многие другие В. вещества. Продукты взрыва пироксилина при малых плотностях газов состоят из СО2, Н2О, СО, Н2 и N2, и с возрастанием плотности наблюдается только увеличение пропорции углекислоты вследствие реакции Н2О + СО = СО2 + Н2, идущей с отделением около +10 Кал.; когда же с дальнейшим возрастанием плотности газообразная смесь на счет этой реакции сильно обогатится водородом, начинает замечаться, кроме того, появление в незначительном количестве болотного газа вследствие реакции 2СО + 2Н2 = СО2 + СН4, происходящей с отделением около +61 Кал., т. е. в рассматриваемом случае избыток кислорода, остающийся после превращения всего углерода в СО, распределяется между этим газом и водородом, с возрастанием плотности отходя все более и более к первому из них благодаря двум указанным побочным реакциям. Пренебрегая образованием болотного газа и выражая состав пироксилина формулой, придаваемой ему Вьейлем («Comp. rend.», t. XCV, p. 132), C24H29O9(NO3)11, разложения его могут быть выражены следующими уравнениями:
| Плотность газов |
С24Н29О9(NO3)11 |
|---|---|
| 0,023 | 15СО + 9CO2 + 9H2O + 5,5H2 + 5,5N2 |
| 0,300 | 13СО + 11CO2 + 7Н2О + 7,5Н2 + 5,5N2 |
| 1,000 | 12СО + 12СО2 + 6Н2О + 8,5Н2 + 5,5N2 |
Для пикриновой кислоты, содержащей еще менее кислорода, реакции, уменьшающие пропорцию СО, проявляются резче, так что образованием болотного газа здесь уже нельзя пренебречь:
| Плотность газов |
8C6H2(NO2)3OH |
|---|---|
| 0,100 | 5,5СО2 + 42СО + 12N2 + 0,5CH4 + 8Н2 + 3Н2О |
| 0,500 | 12,5СО2 + 30,5СО + 12N2 + 4,75СН4 +2Н2 + 0,5Н2О + 0,25С |
т. е. между данными пределами плотности, в то время как только 2,5 частицы СО превратились в СО2 на счет водяного пара, 9 частиц ее исчезли вследствие реакции с водородом. То же самое имеет место и при взрывах неполных азотных эфиров клетчатки, напр. так называемого коллодионного хлопка C24H32O12(NO3)8, отличающегося от обыкновенного пироксилина способностью растворяться в смеси спирта с эфиром и по содержанию кислорода ближе подходящего к пикриновой кислоте.
Хотя таким образом приведенные исследования и подтверждают правило Бертело, однако на основании его можно с точностью предвидеть уравнения разложения только для веществ, богатых кислородом, притом в условиях, наиболее благоприятных для полного окончания реакций. Если же пропорция кислорода недостаточна, то по мере уменьшения ее простые продукты окисления, вступая между собой и с водородом в дальнейшее взаимодействие, более и более дают начало новым продуктам, и тогда распределение кислорода между окисью углерода и водородом, равно как количество болотного газа, без непосредственного анализа является доныне не предусматриваемым.
Еще большую сложность представляют разложения таких смесей, содержащих недостаточное количество кислорода, как обыкновенный порох, так как, что бы ни делали, механическое смешение трех порошкообразных тел никогда не может достигнуть однородности настоящих химических соединений, и следовательно, осуществление одинаковости местных условий горения уже по этой одной причине здесь недостижимо. Отсылая для более близкого изучения разложения обыкновенного пороха к специальным сочинениям (напр. «Traité sur la poudre etc.», par Upmann et Meyer, traduite par Desortiaux), заметим здесь только, что согласно наиболее полному и обширному исследованию Нобля и Абеля состав продуктов взрыва почти не допускает выражения их каким-либо простым химическим уравнением. Главных продуктов, однако, только шесть — три газообразных СО2, СО, N2, три твердых K2SO4, K2CO3, K2S, и если взять средние количества их, выведенные из частных анализов, всегда более или менее отличающихся между собой, то разложение артиллерийского сорта пороха, по Дебусу, может быть представлено уравнением: 8KNO3 + 3,5S + 10,5C = 6,5CO2 + 1,5СО + 4N2 + 2,5K2СО3 + 0,5K2SO4 + K2S3. Бертело, имея в виду те же главные продукты взрыва и выражая состав артиллерийского пороха несколько отличающейся от предыдущей формулой 2KNO3 + S + 3С, считает более вероятным рассматривать всякий случай разложения его как результат комбинации по два, по три и т. д. следующих 5 основных простых реакций, происходящих в различных точках массы:
(1) 2KNO3 + S + 3С = K2S + 3СО2 + N2,
(2) 2KNO3 + 3С = К2СО3 + СО2 + СО + N2,
(3) 2KNO3 + 2,5С = К2СО3 + 1,5СО2 + N2,
(4) 2KNO3 + S + 2С = K2SO4 + 2СО + N2,
(5) 2KNO3 + S + С = K3SO4 + СО2 + N2.
К подобному же заключению привели исследования Н. П. Федорова. Но, какова бы ни была суть дела, факт сложности и колебаний разложения смесей, подобных обыкновенному пороху, остается в полной своей силе, и, несомненно, главная причина его заключается в неоднородности смешения.
Указанные выводы относятся к продуктам, получающимся после охлаждения, но, спрашивается, одинаковы ли они с теми, которые существуют при максимуме температуры, развивающейся во время взрыва? С одной стороны, можно полагать, что некоторые из окончательных продуктов образуются во время охлаждения; так, по предположению Малляра и Ле Шателье, первичные продукты суть всегда продукты прямого горения, т. е. СО2, СО, H2O, H2, N2; такие же газы, как CH4, происходят вследствие вторичных реакций («Mémoriales des poudres et salpêtres», t. II). С другой стороны, несомненно, что СО2 и H2O при возвышенной температуре подвергаются так наз. диссоциации (см. это сл.). Из этих двух причин, могущих определить рассматриваемое нетождество продуктов взрыва, наибольшее значение имеет последняя. Бунзен («An. de Chimie et de Phys.», 4-e série, t. XIV, p. 446), исследуя гремучие смеси СО + O, Н2 +О в 1868, пришел к заключению, что при максимуме температуры, развивающейся при взрыве, только 1/3 их находится в виде окончательных продуктов горения (Н2О и СО2), остальные же 2/3 остаются несоединенными и вступают в соединение лишь по мере охлаждения. Но позднейшие теоретические и экспериментальные исследования показали, что закон природы «действие равно противодействию» (см. Взаимодействие сил) управляет всеми химическими равновесиями и в том числе явлениями диссоциации. Ле Шателье, рассматривая влияние давления на диссоциацию СО2, Н2О и других подобных тел, заключает, что при весьма больших давлениях диссоциация должна быть ничтожно мала, так как СО + О и Н2 + О превращаются в СО2 и H2O с сокращением объема при постоянном давлении или с уменьшением давления в постоянном объеме, а по означенному закону — всякий раз, когда мы подобную систему, находящуюся в состоянии диссоциации, подвергаем увеличенному давлению, в ней непременно возбуждается процесс, стремящийся понизить давление, т. е. наступает частное соединение остававшихся несоединенными частей, влекущее за собой повышение пропорции окончательных продуктов. Впоследствии Ле Шателье («Zeitschr. für Phys. u. Chemie», t. 2, s. 782) нашел из опытов кривую, показывающую, как падает постепенно коэффициент диссоциации СО2 с увеличением давления и стремится к нулю при весьма высоких давлениях. Следовательно, на изменение состава окончательных продуктов при температурах взрыва диссоциация не может оказать заметного влияния вследствие именно громадных давлений, развиваемых взрывчатыми веществами в замкнутых пространствах или при очень быстром сгорании.
Большая или меньшая простота и правильность разложения имеет существенное значение для практических применений В. веществ, так как уравнением его определяется величина механического действия. Если реакции сложны и неопределенны, то от различия и случайности их должны проистекать различие и случайность механических действий. А так как взрывчатые химические соединения разлагаются с гораздо большей простотой и правильностью, чем взрывчатые смеси (порох), то там, где требуется правильность механического действия, им, очевидно, как более доступным управлению, сообразно различным целям практики должно быть отдано предпочтение перед взрывчатыми смесями. Говоря словами Бертело, при употреблении для стрельбы все преимущество грубой смеси, называемой обыкновенным порохом, перешедшей к нам по традиции от прошлых веков, состоит в том, что она развивает свою силу постепенно, но это касается уже другой стороны предмета — скорости разложения, и известным образом возможно умерить эту скорость и для взрывчатых химических соединений.
III. Скорость разложения В. веществ. При изучении этой стороны предмета нужно различать скорость собственно реакций, происходящих в веществе, все части которого подвержены одинаковым условиям температуры, давления и др., от скорости распространения этих реакций в массе, части которой находятся в различных условиях. На практике обыкновенно приходится иметь дело с той и другой скоростью одновременно вследствие принятых способов возбуждения реакций в одной какой-либо точке заряда. Пусть разложение возбуждено с помощью накаленного тела или огня: воспроизведение условий, определяющих разложение от слоя к слою, может совершаться, вообще говоря, с различной скоростью в зависимости от окружающего давления, природы взрывчатого вещества, свойств оболочки и т. п. Наблюдая горение одного большого зерна или нескольких малых зерен обыкновенного пороха, мы замечаем сначала весьма быстрое распространение пламени по поверхности их (воспламенение) и затем более медленное проникновение пламени внутрь — сгорание концентрическими слоями. Если из пороховой смеси приготовить призмы (от 0,5 до 2,5 килогр. весом) с боками, намазанными салом, и расположить их вертикально, то при зажжении верхнего основания происходит горизонтальными слоями горение, скорость которого легко измерить. Пиобер, производя такие опыты на открытом воздухе, нашел, что под обыкновенным давлением для французского артиллерийского пороха она равна от 10 до 13 мм в секунду. Подобным же образом можно изучать скорость горения и под увеличенными давлениями. Отто с этой целью впрессовывал пороховую смесь в трубку с дном, другой конец которой был открыт; изменение давления достигалось изменением количества впрессованного состава. Можно также при исследовании влияния очень больших давлений пользоваться данными о временах пробегания снарядами канала орудий, производя стрельбу изменчивыми количествами пороха и допуская, что заряды сгорают совершенно при вылете снарядов из дула; этим способом Костан нашел, что скорость горения артиллерийского пороха под средним давлением, получающимся в пушках большого калибра, около 320 мм в секунду. С понижением давления скорость горения, наоборот, быстро уменьшается. Так, по опытам Франкланда, произведенным в трубках, в которых постоянное давление во время горения поддерживалось выкачиванием газов с помощью насоса при давлении 722 мм, время сгорания заряда длиной в 152 мм равнялось 30,3 сек., а при давлении 405 мм оно было 45,5 секунд. Такие же результаты получил Сен-Робер при опытах на различных высотах Альп. Когда при понижении давлений дойдем наконец до пустоты, то скорость горения пороха падает настолько, что оно в этих условиях обнаруживается лишь медленным тлением (опыты Бойля, Гюйгенса и др.). Вообще, большая или меньшая скорость горения есть результат большей или меньшей быстроты, с которой нагретые газы удаляются от соседних порций несгоревшего вещества, другими словами — давление определяет число нагретых газообразных частиц, которые в каждое мгновение приходят в прикосновение с не воспламененными еще твердыми частицами. Так как число происходящих при этом ударов на поверхность взрывчатого вещества пропорционально давлению газов, то обозначая через v0 и v скорости горения под атмосферным давлением р0 и давлением р, можно написать: где α должно быть определено из опыта. Результаты измерений показывают, что этот показатель для давлений, меньших 1 атмосферы, равен 0,66, а для значительно больших — величину его можно принять 0,5. Если бы горение происходило в постоянном объеме, то, каково бы ни было давление, начальная температура нагретых газовых частиц была бы чувствительно одна и та же. Но при горении под постоянным давлением, как в вышеизложенных опытах, газы производят внешнюю работу, причем температура их непременно понижается, притом под различными давлениями неодинаково. Кроме того, при производстве опытов неизбежно бывает охлаждение вследствие теплопроводности и лучеиспускания. Поэтому под различными давлениями будет изменяться не только число частиц пороха, нагреваемых в единицу времени при ударах газовых частиц, но и температура нагревания, а именно: при малых давлениях вследствие более благоприятных условий охлаждения эта температура будет ниже, чем при высоких давлениях. Но изучение скоростей химических реакций вообще показывает, что с возрастанием температуры они увеличиваются с гораздо большей быстротой, чем температура; а следовательно, изменение скорости горения с давлением должно быть также результатом и большей или меньшей скорости самих реакций. Другие взрывчатые вещества не были столь подробно исследованы; однако отношения, замеченные для пороха, в большей или меньшей мере повторяются и для них. По наблюдениям Абеля («Liebig’s Jahresb.» 1864, s. 801), горение пироксилина в пустоте происходит столь медленно, что заметно лишь в темноте по являющемуся зеленоватому свету; под давлением около 25 мм замечается небольшое желтоватое пламя, а при давлениях начиная от 76 мм и более пламя делается блестящим. Окружающий разреженный газ при этом не остается без влияния: в то время, как воздух, азот, углекислота, окись углерода, водород, болотный газ не различаются чувствительно по своему действию, чистый кислород повышает напряженность горения, т. е. для одинакового приблизительно замедления горения он требует большого разрежения, что объясняется отделением добавочного количества тепла вследствие дальнейшего горения продуктов разложения на счет кислорода и, следовательно, бо́льшим нагреванием соседних порций пироксилина. Подобным образом происходит в пустоте и горение нитроглицерина. Гремучая ртуть, наоборот, в пустоте от соприкосновения с накаленной проволокой взрывает, но взрыв не передается соседним не прикасающимся порциям, которые только разбрасываются. Под обыкновенным атмосферным давлением, по Пиоберу, скорость горения пироксилина, взятого в виде рыхлой массы, в 8 раз больше, чем обыкновенного пороха; в прессованном же состоянии (в виде шашек или цилиндров, полученных из предварительно измельченной массы), по опытам Абеля, он сгорает медленнее, подобно обыкн. пороху. В таком изменении скорости горения в зависимости от консистенции вещества — изменении, наблюдаемом и у других взрывчатых веществ, прежде всего играет роль диффузия накаленных газов, которые легко проникают в рыхлую массу и ограничиваются только поверхностным слоем в прессованной. Кроме того, при этом важное значение имеет и теплопроводность. Волокна самого пироксилина обладают значительной теплопроводностью; воздух же, содержащийся между волокнами, представляет плохой проводник тепла. Очевидно, в прессованной массе, содержащей в своих порах сравнительно очень мало воздуха, теплота будет распространяться с большей легкостью по всему заряду, а следовательно, части, окружающие точку воспламенения, только в весьма незначительном слое успеют нагреться до температуры разложения. Насколько теплопроводность в самом деле влияет на быстроту горения, это может быть показано посредством следующего простого опыта: скрутив рыхлый пироксилин в нить, помещают последнюю на железный брусок и прикасаются к концу ее накаленным телом; нить тогда тлеет, так как тепло, отделяемое в каждой горящей точке, быстро отнимается железом, представляющим хороший проводник тепла. С другой стороны, скорость горения и прессованного пироксилина можно сильно увеличить, если перед зажиганием нагреем его до температуры несколько ниже точки взрывчатого разложения, напр. до 150°: тогда отвлечение тепла от точки воспламенения ослабится, одновременно будет нагреваться до точки взрыва большая часть окружающей массы, и последняя, будучи уже нагрета предварительно, скорее достигнет этой точки. Подобно прессованному пироксилину, сгорают на открытом воздухе также нитроглицерин (в динамитах) и взрывчатые смеси, содержащие в себе нитросоединения. Из последних — заключающие в себе азотно-аммиачную соль вследствие большой теплоемкости как ее самой, так и образующейся при ее разложении воды вступают в горение только после предварительного нагревания выше 100°, при обыкновенной же температуре, начав гореть, скоро тухнут или даже совсем не загораются. Гремучая ртуть при воспламенении на открытом воздухе дает место настоящему взрыву, сходному с производимым другими веществами только в более или менее прочных оболочках. То же наблюдается с хлористым и йодистым азотом.
Указанные разности в скорости горения В. веществ на открытом воздухе относятся, однако, только к малым зарядам и определяются не только их химическим составом, физическими свойствами, консистенцией, но и сопротивлением окружающего воздуха. Вследствие того, что скорость разложения при передаче его от слоя к слою быстро растет с температурой и количество вещества, одновременно разлагающегося, увеличивается по мере распространения горения, при очень больших зарядах получатся иные отношения. Так, взятые в больших количествах прессованный пироксилин и нитроглицерин, начав гореть спокойно, окончательно так же взрываются на открытом воздухе, как и гремучая ртуть: по мере хода горения температура и с ней скорость разложения слоев постепенно повышаются; газы, вначале свободно преодолевавшие сопротивление атмосферы, испытывая все большее и большее затруднение в передвижении, образуют как бы более и более прочную оболочку для позднее сгорающих слоев, вследствие чего последние будут разлагаться под увеличенным давлением, пока наконец ядро массы не сгорит с наибольшей возможной скоростью. Таков именно механизм явлений, происходящих при пожарах в складах этих веществ, оканчивающихся обыкновенно всегда ужасными взрывами. Гремучая ртуть и вещества, ей подобные, тем только и отличаются главным образом, что способны взрываться на воздухе даже при зажигании малых количеств, т. е. достигать сразу огромных скоростей разложения, при которых окружающие частицы воздуха не успевают уступить нарастающим давлениям и оттого представляют сопротивление расширению газов, сходное с сопротивлением более прочной оболочки.

С малыми зарядами большие скорости горения наблюдаются при воспламенении В. веществ лишь в прочных оболочках. Относящиеся сюда данные были добыты преимущественно Сарро и Вьейлем попутно при изучении давлений. Определяя промежутки времени, в течение которых происходило сжатие медных цилиндриков в крёшере (см. далее VIII), приспособленном к бомбе, из этих промежутков находилось время нарастания давлений до максимума, очевидно, соответствующее быстроте сгорания заряда. Для измерения означенных промежутков времени (см. рис. 4) бомба В, закрепленная в зажиме М, снабжалась крёшером С, так устроенным, что при опытах поршень его посредством прикрепленного легкого пера р мог чертить закон своего движения в течение сжатия цилиндрика на поверхности цилиндра К, вращающегося с известной скоростью. Этот цилиндр покрывается закопченной бумагой и приводится в движение или с помощью электромотора, или посредством падающего груза; скорость вращения его определяется камертоном, снабженным пером, чертящим на бумаге в момент воспламенения синусоиду S, волнам которой соответствует точно определенное предварительно время. До взрыва перо р чертит на цилиндре окружность а, при взрыве — кривую ab и по окончании взрыва, когда прекратилось сжатие цилиндрика, — окружность b. Расстояние между этими двумя окружностями, считаемое по производящей цилиндра К, равно полному сжатию цилиндрика крёшера. Расстояние между производящими, проведенными через а и b, деленное на скорость движения окружности цилиндра, равно времени сжатия цилиндрика крёшера. Из этих найденных описанным способом времен θ получены были следующие продолжительности горения τ (см. VIII) трех важнейших взрывчатых веществ:
| Название вещества и состояние его |
Отношение между весом заряда и ёмкостью бомбы Δ |
Продолжи- тельность сжатия θ в секунд. |
Продолжи- тельность горения τ в секунд. |
|---|---|---|---|
| Обыкнов. порох (порошок) | 0,70 | 0,00165 | 0,00165 |
| Обыкнов. порох (зерна) | 0,70 | 0,00255 | 0,00255 |
| Обыкнов. порох (цил. шашка) | 0,70 | 0,07850 | 0,07850 |
| Пироксилин (порошок) | 0,70 | 0,00032 | 0 |
| 0,70 | 0,00036 | ||
| 0,70 | 0,00034 | ||
| Нитроглицерин (динам. с 25 % кремнезема) | 0,70 | 0,00049 | 0,00026 |
| 0,70 | 0,00047 | ||
| 0,70 | 0,00045 |
т. е. порошкообразный пироксилин сгорает в бомбе с такой скоростью, что, считая точность измерения времени не более 0,0004 секунды, продолжительность τ можно принять равной нулю. Нитроглицерин (в динамите) сгорает уже в измеримый промежуток времени. Скорость сгорания обыкнов. пороха, очевидно, наиболее медленная, уменьшается с возрастанием величины зерен (т. е. с уменьшением поверхности горения) и с увеличением плотности их. Этим путем для пироксилина и динамита не удается получить чувствительного замедления. Однако в последнее время нашли возможность для замедления горения пироксилина: для этого нужно изменить только его состояние более глубоким образом, затрудняющим проникновение газов внутрь массы, что и достигается т. н. желатинизацией, позволяющей из пироксилина или смесей его с нитроглицерином получать более или менее плотные и однородные формы, подобные зернам обыкновенного пороха. Измерениями по методу Сорро и Вьейля можно убедиться, что чем лучше пироксилин (с примесью коллодионного хлопка) желатинирован, тем значительнее замедление его горение; так, при плотн. заряжания Δ = 0,2, этим способом удается увеличить τ до 0,0055. С желатинированными смесями пироксилина и нитроглицерина могут быть достигнуты еще большие значения τ, которые здесь, кроме того, значительно могут увеличиваться и с размерами зерен, как для обыкновенного пороха, а это, по вышесказанному, ведет к тому, что подобные смеси легко могут быть приспособлены к любым задачам В. В.
Способность В. веществ сгорать в различных условиях с большей или меньшей скоростью имеет огромное значение для их практических применений. Из вышеизложенного следует, что хотя все взрывчатые вещества стремятся к максимуму свойственных им скоростей горения, которого и достигают с большей или меньшей легкостью, однако каждому из них свойственна особая скорость реакций разложения, обусловливаемая химическим составом, особый максимум ее, определяемый температурой горения, и особое распространение реакций от слоя к слою, обусловливаемое как постоянными физическими, так и переменными механическими свойствами. В этом отношении В. вещества делят: на крайне быстрые (почти мгновенные), напр. гремучая ртуть, пироксилин, NCl3; быстрые, напр. нитроглицерин (в динамитах), смеси, содержащие в себе различные нитрированные вещества; и медленные, напр. разнообразные пороховые смеси. Меняя состояние или механические условия, можно в известных пределах изменять скорость горения, как, напр., пироксилин через желатинизацию может являться не только быстрым веществом, но и медленным; т. е. резкой границы между означенными рубриками в действительности нет, и они связаны между собой переходами. Медленные вещества применяются для стрельбы из орудий, так как при этом требуется прогрессивное развитие газов с развитием небольших начальных давлений; в противном случае снаряд не успевает сместиться ранее полного сгорания, и получающиеся газы с громадным давлением производят разрушительное действие на стенки канала, срыв снаряда с нарезов и т. п. Крайне быстрые и просто быстрые вещества, наоборот, наиболее пригодны для различных подрывных работ в строительном деле, при проведении сухопутных и водных путей сообщения, в горном деле при разработке рудников, добывания каменного угля и строительных материалов, в земледелии при расчистке лесных площадей, корчевании пней, в минном военном деле и проч. Употребление обыкновенного пороха при этих применениях потребовало бы глубоких буровых скважин, заменяющих прочные оболочки, плотной забивки их, дабы задержать в первый момент образующиеся газы и тем самым дать возможность остальной части заряда сгореть с наибольшей возможной скоростью; кроме того, действие взрыва проявилось бы главнейше в образовании трещин породы по плоскостям наименьшего сопротивления. Быстрые же вещества, не требуя прочной забивки зарядов, производят большее действие и при неглубоком бурении скважин, притом не только делают трещины в окружающих породах, но также более или менее измельчают их и сдвигают с места. Для крайне быстрых веществ бурение скважин делается почти совсем излишним: местное, дробящее действие их осуществляется при простом соприкосновении с разрушаемыми предметами на открытом воздухе, помещая заряды только в слабые оболочки, напр. сделанные из листового цинка или латуни, образование же трещин во всяких условиях с ними наблюдается слабое. Совершенное исключение оболочек все-таки и здесь невозможно, так как даже почти мгновенные разложения непременно требуют некоторого времени. Следующий пример показывает это с совершенной ясностью: капля хлористого азота, свободно положенная на часовом стекле, может взрываться, не разбивая его; но если покрыть ее тонким слоем воды, стекло всегда разбивается.
При производстве взрывных работ, очевидно, важно, чтобы разложение началось с первого же слоя с возможно большей скоростью, что неосуществимо при возбуждении его с помощью накаленного тела вследствие сравнительно невысокой температуры, получающейся при этом в ближайших к точке воспламенения частях заряда. Но в практике заряды обыкновенно взрываются с помощью запалов (см. это слово), представляющих собой также взрывчатые вещества, взятые в малых количествах и способные от накаленного тела или удара взрываться быстро, с развитием более или менее возвышенной температуры. Очевидно, чем выше будет эта температура и чем значительнее масса запала, тем быстрее и больше по количеству взорвутся первые части заряда и, следовательно, все дальнейшие слои, откуда возможность для одного и того же вещества взрываться с переменной скоростью. Преимущественное значение при производстве взрывных работ имеют запалы с гремучей ртутью, т. к. с ними действительно осуществляется наибыстрейший взрыв каждого вещества, называемый детонацией, в отличие от обыкновенного, возбуждаемого накаленным телом, более медленного взрыва. Ближайшее изучение изменения быстроты взрывов в зависимости от природы запалов показывает, что при детонации играет роль совсем даже не температура, а некоторого другого рода действие взрыва их на заряд.
IV. Детонация взрывчатых веществ. Нобель в 1864 году показал, что если в нитроглицерине, свободно поставленном на открытом воздухе, взорвать небольшое количество гремучей ртути в капсюле, то происходит столь быстрое сгорание его, что местное механическое действие заряда превосходит такое при взрыве его накаленным телом в самой прочной оболочке. Сэр Фридрих Абель в 1868 г., применив те же способы взрывания к пироксилину, исследовал явления этого рода подробнее с целью объяснения самого их механизма. Получены были следующие результаты («An. Chim. et Phys»., 4-e série, t. 21, p 97, 1870 г.) а) Гремучая ртуть в капсюле взрывает сухой прессованный пироксилин на открытом воздухе, подобно нитроглицерину, но не взрывает его в рыхлом состоянии; в последнем случае он разбрасывается в стороны, успевая сгорать только частью, б) Чистая гремучая ртуть производит лучшее действие, чем смеси ее с селитрой или бертолетовой солью в пропорции для полного горения. Количества ее в чистом состоянии, необходимые для взрыва сухого прессованного пироксилина, тем меньше, чем прочнее стенки капсюльной трубочки: в латунном капсюле достаточно взять 0,32 гр., а в бумажном требуется 1 гр. ее, если только в обоих случаях снаряженные капсюли будут вдвинуты плотно в сделанное в прессованной массе отверстие. В случае же свободного вставления капсюлей количество гремучей ртути для верного действия необходимо увеличить до 2 гр. и даже более. в) При помещении в капсюли гремучего серебра получаются приблизительно такие же результаты, как и с гремучей ртутью. Хлористый азот производит детонацию прессованного пироксилина лишь в том случае, когда его взято 3,25 гр. и притом под слоем воды. Ни йодистый азот, ни смеси железисто-синеродистых солей с бертолетовой солью (весьма быстро сгорающие), будучи взяты даже в значительных количествах, не взрывают пироксилина. Нитроглицерин, взорванный гремучей ртутью, хотя и может произвести детонацию пироксилина, но его для этого необходимо взять до 60 гр. г) Не только при непосредственном прикосновении, но и на некотором расстоянии, притом — не только в воздухе, но и при отделении слоем воды или даже твердой перегородкой капсюль с гремучей ртутью производит детонацию пироксилина. Так, если в трубке длиной 2 метра и диаметром 30 мм на одном конце поместить 7 гр. пироксилина, а на другом 14 гр. гремучей ртути, то взрыв одного из этих снарядов вызывает взрыв другого. д) Скорость распространения детонации в пироксилине приблизительно равна скорости распространения звука в твердых телах. Эти определения были сделаны с помощью хронографа Нобеля: от длинного, составленного из шашек пироксилина заряда на равных расстояниях проходили отдельные гальванические цепи к ряду вращающихся дисков, дающие на последних при разрыве ряд соответствующих отметок, по расстоянию которых от образующей дисков и угловой скорости вращения можно было судить о быстроте детонации. Такие определения показали, что когда заряд сплошной, то скорость на всем пути постоянна; она увеличивается с плотностью заряда, напр. при изменении плотности от 1,00 до 1,20 — от 5300 до 6100 метров в 1 секунду («An. Chim. et Phys.», 5-е série, t. 2, р. 187, 1874 г.). е) Не только в сухом состоянии, но и в насыщенном водой пироксилин может быть подвергнут детонации. Тогда на него лучше всего действует сам сухой прессованный пироксилин, взорванный гремучей ртутью: при влажности в 20 % нужно употребить для взрывания 31,2 гр. сухого вещества, а при 30 % (предельной влажности) — около 112 гр.
По мнению Абеля, вся совокупность полученных результатов не могла быть объяснена иначе, как при помощи особой гипотезы синхронических колебаний, сущность которой состоит в следующем: В. вещества при своем взрыве производят колебания, подобные звуковым, и характеризуются числом этих колебаний, т. е. высотой тона взрыва. Если два вещества вызывают одинаковые колебания, то как два камертона или две органные трубы, находящиеся между собой в созвучии, при возбуждении звука в одних из них начинают звучать те и другие, так и взрыв одного из таких веществ возбуждает взрыв другого. Пироксилин как во влажном, так и в сухом состоянии со своими детонаторами, по этой гипотезе, имеет общее свойство возбуждать при взрыве синхронические колебания, а вещества, не взрывающие его, взрываются с другим тоном.
Шампион и Пелле, изучая взрывание йодистого азота — вещества, разлагающегося от незначительного трения, видели подтверждение гипотезы Абеля в следующих полученных ими результатах. Если на струнах контрабаса прикрепить кусочки этого вещества и заставить звучать струны другого такого же контрабаса, находящегося на расстоянии, то происходит взрыв только тех из них, которые подвергались действию звука, соответствующего колебаниям числом более 60 в секунду. Кроме того, они помещали между двумя параболическими зеркалами, находящимися в расстоянии 2,5 метров, на линии фокусов в различных точках капли нитроглицерина или кусочки йодистого азота и в одном из фокусов взрывали большую каплю нитроглицерина; тогда взрывались сами собой и порции, находящиеся в фокусе другого зеркала, но не взрывались находящиеся в других точках. Для устранения отражения тепла поверхности зеркал покрывались сажей.
Однако эти опыты мало прибавляют к опытному подтверждению гипотезы Абеля, ибо они совсем не устанавливают факта необходимости некоторых определенных нот для взрывания и указывают только, что ниже известного предела взрывающее действие колебаний прекращается, что высокие ноты действуют безразлично на всякие малопрочные вещества, в таком же виде явления допускают другое толкование.
После исследований Абеля опыты детонации были распространены не только на другие взрывчатые химические соединения, но и на взрывчатые смеси. При этом найдено было, что, подобно влажному пироксилину, для большинства из них недостаточно употребления одного капсюля с гремучей ртутью, но требуется брать еще посредствующий, вспомогательный (запальный) патрон, иначе называемый детонатором: этот патрон детонируется гремучей ртутью, а сам производит детонацию взятого вещества. Так, Ру и Сарро показали, что для детонации обыкновенного пороха нужно употребить посредствующим веществом нитроглицерин. Фавье и Турпен нашли, что прессованные смеси нитросоединений с азотно-аммиачной солью, пикриновая кислота, плавленая и отвердевшая под давлением, взрываются при употреблении вспомогательных патронов из тех же веществ в порошкообразном состоянии. В практике обыкновенно с этой целью чаще всего пользуются сухим прессованным пироксилином или динамитом, содержащим 75 % нитроглицерина, особенно — если заряды представляют вещества плотные, трудно сжимаемые, обладающие большой теплоемкостью. Так как и пироксилин и нитроглицерин отделяют при своем взрыве гораздо больше тепла, чем равное по весу количество гремучей ртути (см. ниже), то достижение детонации именно с этими посредствующими веществами в случаях, заключающих охлаждающие условия в самих свойствах заряда, указывает, что в этого рода явлениях тепловые причины не остаются без существенного участия. С другой стороны, многие факты доказывают, что большая или меньшая чувствительность к взрыванию зависит от сцепления частиц взрывчатых веществ; так, пироксилин тем труднее взрывается гремучей ртутью, чем слабее он спрессован. Взрывчатая желатина (с незначительной примесью камфары) требует особенно энергичного вспомогательного патрона, состоящего из смеси пироксилина с нитроглицерином; а следовательно, в рассматриваемых явлениях существуют еще чисто механические причины, определяющие количества вещества, на которые распределяется действие детонатора.
По опытам Бертело и Вьейля («An. Chim. et Phys.», 6 Serie, t. VI, p. 556), скорость детонации жидкого нитроглицерина возрастает с температурой от 1050 до 3000 метров в секунду; для динамита же величина ее около 5000 метров; нитроманнит взрывается со скоростью около 7700 метров. В последнее время Бертело вместе с Брюно («Mémoriales des poudres et salpêtres», т. IV, p. 7), беря для исследований азотнокислый метил CH3NO3 в длинных трубках, нашли, что скорость детонации этой жидкости зависит от толщины стенок и материала трубок: в каучуковых трубках внутреннего диаметра 5 мм и внешнего 12 мм она равна 1616 метров; в стеклянных внутреннего диаметра 3 мм при толщине стенок 4,5 мм величина ее 2480 метров, а при толщине 2 мм — только 2190 метров; в стальных же трубках того же внутреннего диаметра и толщины 15 мм — около 2150 м, при этом в то время как стеклянные трубки превращаются в пыль, каучуковые и стальные разрываются на длинные пластинки по направлению их оси. Из этих опытов следует, что хотя порядок наблюдаемых скоростей детонации такой же, как и скоростей распространения звука в жидкостях и твердых телах, но на самом деле те и другие относятся к различным явлениям, так как скорость звука определяется только свойствами среды, а скорость детонации зависит и от других условий. Кроме того, опыты Бертело и Вьейля над взрывчатыми газообразными смесями («Sur la force des matières explosives», t. I, p. 133) показывают более решительно, что скорости распространения в них взрыва при воспламенении гремучей ртутью гораздо больше скоростей распространения в них звука; так, смесь Н2 + О взрывается в этих условиях со скоростью 2800 метров в 1 секунду, тогда как скорость звука в ней лишь 514 метров (при 0°).
Бертело («An. Chim. et Phys.», 5 série, t. XX, p. 265, 1880 г.) притом прямо исследовал действие звуковых колебаний, число которых было от 100 до 7200 в секунду, на тела крайне непрочные или даже находящиеся в состоянии постоянного медленного разложения с выделением тепла, как то: озон, перекись водорода, мышьяковистый водород и др., и нашел, что исследованные вещества при этом остаются без заметного разложения.
При изучении передачи детонации между зарядами, находящимися на расстоянии, уяснилось, что на дальность этой передачи влияют не только природа взятых взрывчатых веществ, но также прочность их оболочки, физические свойства и форма отделяющей их среды, т. е. опять условия, регулирующие чисто механические явления. Через твердые тела взрыв передается легче, чем через воду и воздух. Напр. для динамита (с 55 % нитроглицерина) Памар получил следующие результаты («Mémorial de l’officier du Génie», 1874 г., № 22): а) материал оболочек зарядов оказывает влияние в таком направлении, что с увеличением прочности его дальность передачи увеличивается; б) называя заряд с гремучим капсюлем активным, а заряд без капсюля пассивным, эта дальность зависит только от величины активного заряда; в) на ровной почве (в цинковых коробках) зависимость между величиной активного заряда С (в килограммах) и расстоянием е (в метрах) передачи детонации выражается приближенно формулой е = 0,9С, причем это отношение справедливо только для почвы в Версале и увеличивается вообще с твердостью почвы; г) при подводных взрывах дальность уменьшается, так что, напр., заряд в 3 килограмма вызывает взрыв пассивного заряда только на расстоянии 2 метр.; д) между зарядами, подвешенными в воздухе, передача детонации хотя и имеет место, но чрезвычайно трудно. Через правильные формы сред, напр. через цилиндры, призмы и т. п., детонация передается на гораздо большие расстояния; так, помещая заряды динамита (с 52 % нитроглицерина) на железных рельсах, получается зависимость между е и С, выражаемая формулой: е = 7,0С. Если два динамитных заряда соединить между собой трубкой, то расстояние передачи увеличивается с прочностью материала трубки, ее диаметром (при возрастании до 4 сантим.) и степенью гладкости внутренних стенок.
Явления детонации, по Бертело, во всех отношениях объясняются удовлетворительнее на основании термодинамики. В самом деле, не только сообщение огня, но и удар возбуждает горение В. веществ, притом гораздо более быстрое. Капля нитроглицерина, занимающая на железной подставке 2 кв. мм, взрывается при падении на нее железного груза весом в 4,7 килогр. с высоты 0,25 метра. Пироксилин, хотя и труднее, точно так же взрывается при ударе между твердыми металлическими поверхностями, если он взят в тонком слое. Вообще, при достаточно сильном ударе все В. вещества дают место по крайней мере частному взрыву. Примешивание посторонних инертных тел, как, напр., кремнезема к нитроглицерину, воды к пироксилину, камфары к гремучему студню и т. п., не уничтожает окончательно чувствительности взрывчатых веществ к удару; динамит с небольшим содержанием нитроглицерина, прессованный пироксилин, напитанный водой, будучи не чувствительны к обыкновенным ударам, взрываются при стрельбе бомбами, начиненными этими веществами, в толстые стальные брони вследствие необычайно сильного удара, претерпеваемого передними частями заряда в момент встречи бомб с броней. По термодинамической теории такое действие удара совершенно понятно. Окончательная причина взрыва и здесь заключается в нагревании, но только иначе сообщаемом, чем при действии огня.
Давления, происходящие от удара на поверхность вещества, слишком быстры, чтобы распространиться однообразно по всей массе; уничтожившаяся живая сила ударившегося груза превращается в теплоту, и это превращение будет иметь место главным образом в верхних слоях, подвергшихся удару; отсюда последние, крайне быстро нагреваясь до возвышенной температуры, взорвутся со скоростью, отвечающей этой температуре, и живая сила частичных движений взорвавшихся слоев увеличится на все количество отделившегося тепла. Взрыв первых слоев произведет новый удар, очевидно еще более сильный, на следующие слои; в последних повторится то же самое, что и в предыдущих, и т. д., от слоя к слою, пока через такой цикл явлений механических, тепловых и химических, превращающихся друг в друга с чрезвычайной быстротой, не произойдет полный взрыв взятого вещества или пока не встретятся какие-либо механические, тепловые или химические условия, останавливающие распространение превращений. Прибегая к математическому выражению соотношения между живой силой удара и давлениями на всю ударную поверхность в момент остановки груза, является возможность вывести все частности рассматриваемых явлений. Действительно, это соотношение выражается формулой: где p — давление, l — путь, пройденный грузом в теле, m — вес груза, v — скорость его, g — ускорение (единицы — килограмм и метр). Если остается постоянным, то при одной и той же ударной поверхности давление будет получаться тем значительнее, чем меньше l, т. е. чем труднее вещество сжимается, и наоборот; а так как работа pl превращается в теплоту, то эта теплота в трудно сжимаемых веществах пойдет на нагревание более тонкого слоя их и потому нагреет его до более возвышенной температуры, чем в легко сжимаемых веществах; оттого слабо спрессованный пироксилин, студенистый динамит и друг. подобные вещества сильнее сопротивляются удару. С другой стороны, при одинаковом приблизительно l давления p увеличиваются с уменьшением ударной поверхности; оттого часто вещества, малочувствительные к удару между широкими твердыми поверхностями, легко взрываются при ударе острыми твердыми предметами, напр. при разрубании замерзших динамитов топором. Анализ той же формулы приводит к объяснению влияния мягкости твердых предметов, между которыми производится удар, так как величина l определяется суммой всех сжатий, происшедших при ударе. Поэтому вещества, не рвущиеся при ударе между деревянными и свинцовыми предметами, рвутся между железными или стальными и т. д. Если ко взрывчатому веществу подмешано постороннее инертное тело, то только часть работы сжатия приходится на долю собственно взрывчатого вещества, вследствие чего температура нагревания его понижается, особенно в присутствии вещества с такой большой теплоемкостью, как вода, и тогда для взрывания нужно применить гораздо больший удар, увеличив .
Совершенно таков же механизм и явлений детонации: гремучая ртуть и вообще детонаторы, почти мгновенно превращаясь в газы, производят более или менее сильный удар на прилегающий заряд, вследствие чего от слоя к слою, переходя в каждом через тройной цикл превращений механических, тепловых и химических, правильно повторяются условия наиболее быстрого и сильного нагревания. Гремучая ртуть в опытах Абеля потому и является наилучшим детонатором, что она, будучи взята в прессованном (до плотности 4,4) состоянии, способна производить самый сильный удар, так как газообразные продукты ее взрыва, мгновенно образующиеся, в первый момент стремятся занять объем, равный объему самой соли, а в таком случае мгновенное давление должно быть необычайно большое. Ни хлористый азот, ни нитроглицерин не могут развить столь громадных давлений вследствие своей меньшей плотности или быстроты взрыва. Роль вспомогательных запальных патронов объясняется теми условиями, которые определяют превращение живой силы в теплоту в большей или меньшей массе первых слоев заряда, подвергшихся удару. Если взяты взрывчатые вещества, трудно сжимаемые и обладающие большой теплоемкостью, то при взрывании их нужно осуществить такие условия, чтобы первые слои в значительной массе подверглись детонации, ибо в случае незначительности этого слоя взрыв его не может произвести достаточно сильного удара на дальнейшие слои вследствие присутствия охлаждающих причин; а для этого необходимо: 1) взять детонатор в увеличенном количестве, 2) такой, который не только развивал бы громадные давления, но и сообщал бы первым слоям большую работу. Это и осуществляют обыкновенные патроны, состоящие из нитроглицерина (динамита) или пироксилина, так как оба эти вещества по сравнению с гремучей ртутью хотя развивают меньшие давления, но на единицу веса производят гораздо большую работу. Однообразие скоростей детонации по всей длине заряда есть результат правильного повторения в данных условиях от слоя к слою одного и того же тройного цикла превращений.
Очевидно, хотя ход явлений подобен распространению звука в средах, но по существу мы встречаем здесь совсем новый род волнообразного движения. По аналогии со звуковыми волнами эти новые волны Бертело называет взрывными. В то время, как первые представляют правильные повторения только механических сжатий и разрежений среды по закону сохранения энергии, последние суть правильные повторения от слоя к слою тройного цикла явлений, переходящих друг в друга, — сжатия, нагревания и взрыва.
Для более точной характеристики нового рода волнообразного движения и в то же время для проведения границы между детонацией В. веществ и обыкновенным горением их от накаленного тела могут служить результаты, полученные Бертело и Вьейлем («Sur la force des matières explosives», t. I, p. 133) со взрывчатыми газообразными смесями. Если такие смеси поместить в длинные (каучук., металлич.) трубки, то при воспламенении их с одного конца с помощью очень малого количества гремучей ртути хронограф, соединенный с различными частями системы, показывает, что скорость возбуждаемой взрывной волны по всему пути однообразна и зависит только от природы газовой смеси, напр. она равна 2800 метрам для Н2 + O, 1100 метрам для СО + О; материал трубок не оказывает влияния; лишь иногда в начале и в конце трубки замечается менее быстрое горение.
Причина постоянства скоростей и зависимости их лишь от состава смеси понимается из того сближения, что эти скорости оказываются почти равны скоростям движения соответственных газообразных частиц при тех температурах, которые развиваются взрывом их (см. Кинетическая теория газов), так как, напр., для системы Н2 + О эта скорость вычисляется около 2830 метров в секунду; если же действительно существует такое соотношение, то взрывные волны, очевидно, не могут передвигаться быстрее, чем сами частицы. Но можно себе представить, что какой-либо слой газовой смеси вследствие случайного охлаждения предыдущего слоя претерпит менее сильный удар; тогда в нем произойдет меньшее нагревание и в связи с последним более медленное горение; необходимо то же повторится затем в дальнейших слоях, и в результате скорость волнообразного движения получится для той же смеси меньше. Вследствие влияния охлаждающих причин удар может ослабиться настолько, что последующий слой получит работу, недостаточную для воспламенения; тогда пойдет обыкновенное горение, как от накаленного тела, распространяющееся вследствие простого обмена теплоты между сгоревшими и несгоревшими частями, и скорости еще более понизятся, достигая таких величин, которые наблюдаются при вытекании смесей из тонких отверстий, когда, напр., смесь H2 + О, по опытам Бунзена, сгорает со скоростью 34 метр. в сек. Точно так же можно себе представить, что при медленном горении на счет отделяющегося тепла получится в одном из дальнейших слоев столь сильное повышение температуры, что он взорвется со значительно большей скоростью; тогда, предположив, что удар на следующий слой будет достаточен для его воспламенения, начнется взрывная волна. Этот случай чаще всего имеет место в практике при воспламенении взрывчатых газовых смесей в запертых сосудах. Вышеуказанные меньшие скорости взрывной волны в начале и конце пути представляют не что иное, как постепенные переходы — то к предельной наибольшей величине ее вследствие усиления нагревания, то к более медленному распространению процесса вследствие охлаждения. Очевидно, и при распространении горения через посредство взрывной волны одна и та же система может взрываться с различной скоростью, подобно тому как при распространении его через простой обмен тепла между сгоревшими и несгоревшими слоями.
Распространяя этот вывод и на обыкновенные твердые и жидкие В. вещества, должно заключить, что вне прочных оболочек и при малом количестве В. вещества явление обусловливается энергией первоначального импульса, производимого запалом: чем сильнее удар, производимый в точке воспламенения, тем быстрее совершится горение. Но все разнообразные скорости горения будут заключены между двумя крайними пределами, из которых высший есть детонация, соответствующая в данных условиях наибольшей и однообразной скорости взрывной волны, т. е. максимальному нагреванию слоев и максимальным скоростям самих реакций, а низший — прогрессивное горение, соответствующее условиям, когда охлаждающие причины понижают нагревание каждого слоя до самой низкой температуры, допускающей распространение реакций. Переход прогрессивного горения в детонацию совершается тем легче, чем далее по своей природе взятое вещество отстоит от медленных взрывчатых веществ и чем более приближается к крайне быстрым. Отличие взрыва твердых веществ от взрыва газов заключается только в том, что на скорость распространения взрывной волны здесь оказывают влияние, кроме натуры В. вещества, еще структура его (рыхлая, сплошная или порошкообразная кристаллическая масса) и мгновенное, отличающееся от статического, сопротивление оболочек разрыву. По Бертело, это так и должно быть. В самом деле, обыкновенные взрывчатые вещества чаще всего занимают меньший объем, чем тот предельный, до которого могли бы быть сжаты газообразные продукты горения (СО2, СО, Н2О, N2, H2, O2), когда частицы их, сближенные до прикосновения, уподобились бы частицам жидкой, почти несжимаемой воды. Основанием для такого заключения служит изучение удельного веса этих газов в жидком состоянии при очень низких температурах; этот уд. вес можно принять приблизительно равным единице, между тем как удельные веса твердых В. веществ обыкновенно больше этой величины. Отсюда при взрывах веществ в собственном объеме должны получаться давления выше всякой величины, доступной измерению в наших опытах. С другой стороны, теория упругости материалов показывает, что сопротивление трубок, увеличиваясь с толщиной стенок, стремится к некоторому определенному пределу, переходя который, трубки разрываются, какова бы ни была их толщина; следовательно, при взрыве твердых и жидких веществ в собственном объеме всякая оболочка необходимо должна разорваться прежде, чем произойдет детонация всего заряда, и это непременно случится в известный момент, определяемый мгновенным сопротивлением стенок. Очевидно, чем ближе к предельной величине мгновенное сопротивление, тем до большей величины успеют возрасти давления каждого взрывчатого слоя, а с ними — удар на соседние слои, температура последних и скорость детонации. Если трубка однородна, вещество наполняет ее однообразно и обладает такой структурой, что давления и реакции могут правильно распространяться от слоя к слою, то по мере того, как распространяющееся давление будет достигать известной величины, правильно будет разрываться и сама трубка от слоя к слою, так что установится некоторая специальная однообразная скорость детонации, определяемая данными условиями. Зависимость скоростей от структуры самих взрывчатых веществ есть результат того же рода соотношений, так как предельная величина давлений во взрывающих слоях определяется также мгновенным сопротивлением и их самих.
Не менее удовлетворительным с точки зрения теории взрывной волны является и объяснение передачи взрывов между зарядами, находящимися на расстоянии. Активный заряд возбуждает в окружающей среде обыкновенную механическую волну, отличающуюся от звуковой только огромным своим напряжением. При встрече с пассивным зарядом она производит сильный удар, возбуждающий в этом заряде взрывную волну. В телах правильной формы — призмах и цилиндрах, в которых при распространении по длине поверхность волны можно принять плоской, передача энергии благодаря равенству поперечных сечений происходит с малой потерей (только на посторонние работы), между тем как в телах, занимающих неопределенно большое протяжение, вследствие образования шаровых волн с увеличивающимися поверхностями по мере удаления от точки распространения энергия на единице поверхности их убывает обратно пропорционально квадратам расстояний, т. е. передача взрывов через цилиндры и призмы должна происходить на большие расстояния, чем в неопределенно протяженных средах, как это и показывают опыты. Тела твердые сравнительно с жидкостями и газами потому и передают лучше взрывы, что в них скорость распространения волнообразного движения вообще больше.
Перейдем теперь к рассмотрению дальнейших свойств В. веществ, как то: объема газов при взрыве, количества отделяющегося тепла, температуры газов, давления их и работы.
V. Объем постоянных газов (при нормальных условиях, т. е. при 760 мм давления и 0°), происходящих при взрыве, измеряется для какого-либо В. вещества попутно при изучении его разложения, переводя газы в ртутный газометр (см. рис. 3). Но рядом с постоянными газами при возвышенной температуре, развиваемой взрывом, образуются вода, ртуть и другие летучие продукты, которых объем также важно знать с точностью. Для общего объема продуктов, принимающих газообразное состояние, можно пользоваться следующим приемом расчета, дающим для постоянных газов совершенно согласные с опытом результаты. По закону Авогадро-Жерара, граммовые частицы всяких тел, сложных и простых, в газообразном состоянии при одинаковых условиях занимают равные объемы, а именно: литров, т. е. при некоторой высокой температуре таков будет объем 2 гр. Н2, 32 гр. О2, 28 гр. СО, 44 гр. CO2, 28 гр. N2, 18 гр. H2O, 200 гр. Hg и т. д., независимо от их физического состояния, при обыкновенной температуре. Так как общий объем паров и газов важно знать собственно для давлений, то фиктивно в вычислениях можно принять, что и при 0° они все занимали бы одинаковый объем, равный 22,32 литрам, если бы не переменили своего состояния. Поэтому если граммовая частица взрывчатого вещества есть А и оно разлагается по уравнению:
где ω1, ω2, ω3… суть частичные веса продуктов разложения, а n1, n2, n3… количества частиц, то объем VA газов, развиваемых А гр. вещества при нормальных условиях, выразится через: va = 22, 32(n1 + n2 + n3… ) литров.
Принято обыкновенно относить результат V0 к 1 килограмму вещества. Если в формулу вставим n1, n2, n3…, относящиеся только к постоянным газам, то получится объем, допускающий опытную поверку. Следовательно, уравнение разложения прямо дает искомый объем газов. Так, для нитроглицерина вычисляется при воде жидкой V0 = 467 литров, при воде газообразной V0 = 713 литр., непосредственное же измерение (Сарро и Вьейль) дает 467 литров. Следующая таблица содержит V0, считая воду и другие подобные тела в газообразном состоянии, для важнейших В. веществ:
| Название вещества | V0 |
|---|---|
| Обыкнов. артил. порох[2] | 300,9 |
| Сухой пироксилин | 859 |
| Нитроглицерин | 713 |
| Гремучая ртуть | 314 |
| Панкластит 3NO2 + CS2 | 469 |
| Гельгофит 4HNO3 + С6Н4(NO2)2 | 690 |
| Беллит 10NH4NO3 + С6H4(NO2)2 | 899 |
Очевидно, кроме способности вполне превращаться в газы, на объем их оказывают влияние: 1) вес атомов элементов, входящих в состав, что само собой понятно при расчете на весовую единицу; 2) большая или меньшая полнота сгорания, так как наибольшие объемы получаются не при полном сгорании С в СО2 и Н2 в Н2О, а при неполном (когда С превратился бы в СО, а водород остался бы свободным) вследствие сжатия при образовании СО2 и H2O из СО + О и Н2 + О.
VI. Теплота разложения. Количество тепла, отделяющегося при взрыве, может быть измерено непосредственно с помощью обыкновенных калориметрических приемов (см. Калориметрия). При этом нужно соблюсти только следующие определяющие наибольшую точность измерений условия: 1) разложение вещества в калориметрической бомбе необходимо производить в атмосфере инертного газа, например азота, ибо в противном случае кислород остающегося в ней воздуха будет участвовать в горении и через это окажет влияние на результат, тем большее, чем меньше кислорода содержится в самом веществе и чем меньше взят заряд; 2) стенки бомбы должны быть сделаны из металлов, не способных к окислению. Калориметрическая бомба в наиболее выработанном виде, предложенная Бертело, состоит из следующих частей (см. рис. 5). Стальные стенки ее D и притертая крышка ЕЕ выложены внутри платиной для устранения химического действия на них продуктов горения. Крышка прижимается с помощью гайки FF; через стальной придаток А проходит винтовой кран CB для запора и выпускания газов. Воспламенение заряда производится, накаливая током проволоку f, прикрепленную между изолированным конусом M и штифтом, ввинченным в крышку. При самом измерении, кроме обыкновенных калориметрических предосторожностей, нужно обратить внимание главным образом на то, что вследствие значительной толщины стенок бомбы передача тепла от продуктов горения калориметру происходит и после того, как получился максимум температуры, т. е. для вычисления поправок на охлаждение калориметра необходимо к концу наблюдений дождаться равномерности.

Но при современном богатстве числовых данных относительно теплот образования из элементов разнообразных химических соединений (см. Термохимия) возможно получить точные величины теплот разложения В. веществ и помимо прямых измерений, пользуясь только термохимическими таблицами — во всех случаях, когда точно известны уравнения их разложения. Напр., зная, что при взрыве двух граммовых частиц нитроглицерина образуются: 6CO2 + 5H2O + 3N2 + 0,5O2, по этим таблицам находим, что теплоты образования из элементов каждой граммовой частицы сложных продуктов: СО2 из алмаза и кислорода = +94 Кал., Н2О жидкой из водорода и кислорода = +68,8 Кал., Н2О газообразной = +58,2 Кал., а теплота образования из элементов свободных простых тел (по условию) равна нулю, откуда для данных количеств этих газов получится сумма 6 x 94 + 5 x 68,8 Кал. (при жидкой воде), или 6 x 94 + 5 x 58,2 Кал. (при газообразной воде). Простые тела, входя в соединение между собой, при образовании каждой граммовой частицы нитроглицерина теряют часть своей энергии в виде тепла, а именно +98 Калор., как находим в тех же термохимических таблицах, и потому при дальнейшем превращении в CO2, Н2О, N2, и О2 (т. е. при взрыве) по закону сохранения энергии должны отделить на это количество меньше тепла. Очевидно, уменьшая выше найденную сумму на 2 x 98, мы и получим теплоту разложения 2 граммовых частиц нитроглицерина. Относя результаты к 1 килограмму, окончательно найдем 1570 Кал. (при воде жидкой) и 1458 Кал. (при воде газообраз.). Следовательно, вообще теплота разложения какого-либо взрывчатого вещества равняется сумме теплот образования из элементов продуктов взрыва без теплоты образования из элементов его самого. Отличают теплоты разложения взрывчатых веществ при постоянном давлении qp и при постоянном объеме Qv, притом считая воду и подобные продукты то в жидком, то в газообразном состоянии. По термохимическим таблицам находятся собственно Qp, опытом же в калориметрической бомбе определяются Qv, считая воду жидкой, что нужно иметь в виду при сравнении опытных данных с вычисленными. Однако известным образом можно перейти от Qp к Qv и обратно, зная объем газов. Беря тот же пример нитроглицерина, для которого Сарро и Вьейль опытно нашли Qv = +1600 Кал., представим себе вертикальный прямоугольный параллелепипед с площадью поперечного сечения в 1 кв. дециметр и в нем поршень, на который давит 1 атмосфера, или, другими словами, — груз в 103,33 килограмма. Если, удерживая поршень на расстоянии 1 дециметра от дна, взорвем под ним 1 килограмм нитроглицерина, то газы, занимающие при нормальных условиях объем в 713 литров (при газообразной воде), или 467 литр. (при жидкой воде), поднимут поршень с грузом на высоту 71,3 или 46,7 метров, т. е. произведут работу, равную 103,33 x 71,3, или 103,33 x 46,7 килограммометров.
На эту же работу затратится определенное количество тепла q, а именно Кал., или Кал.; между тем как если бы поршень был удержан в своем первоначальном положении, то внешняя работа не была бы произведена и вся затраченная на нее теплота осталась бы в газах. Следовательно, вообще Qp меньше Qv на q и в частности для нитроглицерина Qv (при жидкой воде) равно Qр x q = 1570 + 11 = 1581 Кал., что уже близко подходит к величине, найденной Сарро и Вьейлем. Опытные измерения теплот разложения являются особенно необходимыми во всех случаях, когда уравнения разложения с какой-либо стороны остаются неопределенными. В следующей таблице даны Qp и Qv для тех же В. веществ, для которых выше были приведены V0.
| Название вещества | Qp | Qv | ||
|---|---|---|---|---|
| При Н2О жидкой |
При Н2О газообр. |
При Н2О жидкой |
При Н2О газообр. | |
| Обыкновен. артил. порох[2] | 690 | 690 | 697 | 697 |
| Сухой пироксилин | 1074 | 1022 | 1087 | 1041 |
| Нитроглицерин | 1570 | 1458 | 1581 | 1475 |
| Гремучая ртуть | 403 | 349 | 408 | 356 |
| Панкластит | 1111 | 1111 | 1122 | 1122 |
| Гельгофит | 1572 | 1478 | 1583 | 1494 |
| Беллит | 1226 | 999 | 1235 | 1021 |
Указанным способом находятся количества тепла, отделяемого В. веществами при условии отсутствия каких-либо внешних работ, произведенных во время взрыва; если же последние производятся, как это бывает при практических применениях, то вследствие затраты на них части тепла его отделяется меньше. Тогда нахождение остающегося количества теплоты приводится к определению действительных произведенных взрывами работ (см. ниже, работа В. веществ).
VII. Температура, развиваемая взрывчатыми веществами, до сих пор представляет непреоборимые затруднения для непосредственного измерения. Доныне известно лишь то, что температура, получающаяся при взрыве обыкновенного пороха, лежит выше температуры плавления платины (1800°). Остается поэтому определять температ. вычислением на основании известного соотношения между температурой t, теплотой, ей сообщаемой, Q и теплоемкостью с по формуле Но, принимая Q те же, какие соответствуют продуктам после охлаждения, а с тождественными с известными для температур, недалеких от обыкновенной, по этой формуле вычисляются t, весьма отдаленные от действительных температур. Причина неточности подобных расчетов, главным образом, заключается в изменении теплоемкости с температурой, так как неполным тождеством продуктов взрыва при максимуме температуры и после охлаждения и связанной с этим некоторой неопределенностью в количестве тепла, участвующего в нагревании, можно пренебречь.
В недавнее время, с одной стороны, Малляр и Ле Шателье («Recherches expérimentales et théoretiques sur la combustion des mélanges gazeus explosifs», Париж, 1883), с другой — Бертело и Вьейль («An. de Chimie et de Phys.», 6-e série, t. 4, p. 13) подвергли изучению температуры, получающиеся при горении взрывчатых газовых смесей в бомбах, измеряя давления продуктов горения, т. е. произвели приближенную оценку этих температур по шкале воздушного термометра. Очевидно, деля количества тепла при постоянном объеме, соответствующие горению смесей, на найденные температуры, получим средние теплоемкости продуктов взрыва при постоянном объеме между пределами от 0° до этих температур, если только при взрыве не было диссоциации. Более точными являются результаты, принадлежащие Малляру и Ле Шателье, так как, разбавляя смеси инертными газами, эти авторы избегали получения особенно высоких температур, при которых можно было ожидать диссоциации Н2О и СО2, между тем как Бертело и Вьейль не прибегали к подобному приему. Если возьмем так называемые частичные теплоемкости, т. е. произведения средних теплоемкостей, отнесенных к 1 гр., на частичные веса соответствующих газов, то оказывается — они растут с температурой по формуле cv = а + bt, где а и b постоянные зависящие от состава газа, а именно:
| для | СО2 сv | = | 6,26 + 0,0037t | мал. | кал. |
| Н2О сv | = | 5,61 + 0,0033t | |||
| Н2, N2, СО, О2 cv | = | 4,80 + 0,0006t |
Хотя температуры в опытах Малляра и Ле Шателье не шли выше 2500°, однако, предполагая, что найденные формулы для сv прилагаются и при дальнейшем нагревании, авторы нашли возможным вычислить температуры горения важнейших В. веществ («Mémoriales des poudres et salpêtres», t. II, p.) по формуле причем Q’v выражено в малых калориях и отнесено к граммовой частице вещества (при газообразной воде), а постоянные а и b для смеси газов, состоящих вообще из αСО2, βH2O и λ(CO, N2, H2, O2), определены из равенств: а = 6,26α + 5,61β + 4,8λ и b = 0,0037α + 0,0033β + 0,0006λ.
| Название вещества | t |
|---|---|
| Пироксилин | 2660° |
| Нитроглицерин (в динамите с 25 % кремнезема) | 2940° |
| Нитроманнит | 3250° |
| Азотно-аммиачная соль | 1130° |
| Беллит | 2190° |
и др.
Очевидно, наиболее высокие температуры получаются для нитроглицерина и нитроманнита вследствие наибольших количеств тепла, отделяющегося при их взрыве. Главное замечание, которое можно здесь сделать, состоит в том, что неизвестно в действительности, применяются ли вышеуказанные формулы теплоемкостей выше пределов температур, при которых они найдены. Хотя Бертело и Вьейль, имевшие в своих опытах над газами температуры до 4000°, подтверждают факт продолжающегося возрастания теплоемкостей, но полученные ими числа при столь высоком нагревании суть кажущиеся теплоемкости, т. е. представляют средние количества тепла, идущего не только на нагревание, но и на диссоциацию. Кроме того, при взрыве газовых смесей вследствие незначительности их массы на давление должно оказывать влияние охлаждения стенками бомбы, а это необходимо скажется на величинах вычисляемых теплоемкостей[3].
VIII. Давление (сила), развиваемое при взрыве, есть результат превращения вещества в газы и нагревания последних до возвышенной температуры. Оно определяется не только объемом газов и температурой их, но также отношением веса взятого вещества к объему зарядной камеры, или т. н. плотностью заряжания. Наибольшая величина его при невысоких плотностях заряжания может быть измерена или непосредственно, или найдена вычислением.
Непосредственное измерение давлений, как вообще всякой силы, осуществляется двумя приемами: статически, т. е. приискав силу, уравновешивающую давление продуктов разложения, или динамически, т. е. определив закон движения, сообщенного какому- либо весомому телу. Самый первый способ измерения был дан Румфордом в 1792 году, который, производя взрывы обыкновенного пороха в укороченной небольшой пушке, поставленной вертикально, подыскивал груз, уравновешивающий давление газов. Отсылая для более близкого знакомства как с этим способом, так и со многими другими, сюда относящимися, к специальным сочинениям («Traité sur la poudre etc.» par Upmann et Meyer, ouvrage, traduit par Desortiaux), упомянем здесь только о более важных.

Из основанных на статическом приеме в настоящее время применяются: 1) способ Родмана (1857 г.), в котором о величине давления судят по размерам углубления, производимого в плитке из красной меди посредством пирамидального стального ножа, приделанного к поршню, передающему действие газов; 2) крешер Нобля (1868 г.), позволяющий выводить давление газов, передаваемое также через поршень, из сжатия небольшого медного цилиндрика. Между динамическими более примечательны способы Марсель-Депре, предложившего: 1) акселерометр, т. е. измеритель начальных скоростей поршня, подверженного действию газов; 2) акселерограф, в котором закон движения поршня выводится из кривой, получаемой на закопченной пластинке, к нему прикрепленной. Остановимся ближе только на измерениях с помощью крешера. Опыты производятся в манометрической бомбе. Она представляет толстостенную трубку из мягкой стали, скрепленную снаружи другой такой же трубкой, и снабжена на открытых концах внутренними винтовыми нарезами для ввинчивания укупоривающих пробок, одной — с крешером, другой с приспособлением для воспламенения (рис. 2 и 4). С помощью гальванического тока накаливают тонкую железную или платиновую нить, натянутую между штифтами, из которых один прикреплен к пробке, а другой к конусу, пригнанному точно к каналу и изолированному с помощью полоски животного пергамента или посредством тонкого слоя лака; при взрыве конус с силой вдавливается в канал и не допускает ни малейшего выхода газов. Но газы могли бы выходить через винтовые нарезы между пробками и стенками бомбы; для предупреждения этого под обеими пробками помещаются кольцеобразные медные обтюраторы, пригнанные к каналу бомбы, в этих местах немного сточенному, так что пробки могут прижиматься к обтюраторам, а взрывом они еще плотнее придавливаются друг к другу. В такой бомбе безопасно можно измерять давления, не превосходящие 4000 килогр. на 1 кв. сантиметр. Крешер приспособляют к одной из пробок (см. рис. 6). В канале пробки двигается хорошо пришлифованный, из закаленной стали, поршень а с определенным сечением, напр. 1 кв. сант.; для лучшего устранения прорыва газов на конце его, обращенном внутрь бомбы, делаются круговые канальцы b, смазываемые салом; кроме того, накладывается медный обтюратор f. Поршень под влиянием газов давит непосредственно на медный цилиндрик γ в 13 мм высотой и 8 мм диаметром, установленный посредине с помощью каучукового кружка ее и другим своим основанием упирающийся в стальной винт d.

Самую существенную часть прибора составляет этот медный цилиндрик, который, соответственно давлению, сжимается на известную величину. Фиг. 7 представляет формы его в различных степенях обжатия. Эти цилиндрики обыкновенно заготавливаются сразу в большом количестве; из однородных полос чистой меди и подвергаются предварительному отжиганию. Хорошо приготовленные образцы сжимаются совершенно правильно; основания при сжатии всегда сохраняют форму правильного круга, а боковая поверхность остается гладкой. Для пользования цилиндриками составляется опытным путем таблица, показывающая зависимость между сжатиями их и соответствующими давлениями. Рациональный метод для составления таких таблиц был указан только в недавнее время (1883 г.) Сарро и Вьейлем, которые обстоятельными опытами констатировали, что сжатие цилиндрика крешера при данной сжимающей силе зависит от того, будет ли эта сила приложена сразу или будет возрастать постепенно от нуля до определенной величины, и, кроме того, от веса поршня, через который передается давление.
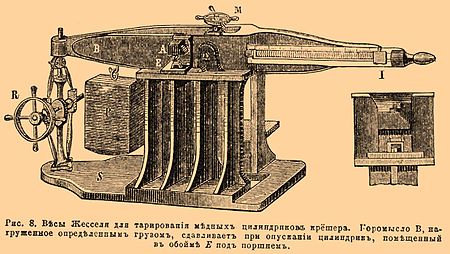
При составлении таблицы Сарро и Вьейль пользовались весами Жесселя (см. рис. 8). Через коромысло В, опирающееся своим ножом на верхушку массивной чугунной подставки, проходит длинный стержень, половины которого снабжены винтовыми нарезками в обратном направлении, так что при поворачивании винта М с одной стороны указатель J, с другой — груз P двигаются одновременно то к концам, то к середине коромысла. К одному из концов приспособлен параллелограмм, с помощью которого, вращая колесо R, можно более или менее быстро опускать коромысло с грузом. Сдавливание производится с помощью зубца А: цилиндрик ставится на столик, приделанный спереди, под стальным поршнем, движущимся внутри обоймы E и принимающим давление зубца А. Непосредственный опыт убеждает, что если некоторая сжимающая сила Т килогр. сразу приложена к медному цилиндрику, так что она остается постоянной во все время обжимания, то полное сжатие ε мм получится вдвое более, нежели в том случае, когда сила, возрастая от нуля, постепенно достигнет той же величины Т. Таблица составляется при медленном нарастании давлений. С этой целью, по Сарро и Вьейлю, наиболее удобно поступать следующим образом: поставив груз P так, чтобы на поршень обоймы Е получалось требуемое давление Т, и поместив цилиндрик под поршень, с помощью параллелограмма доводят коромысло до прикосновения зубца А с поршнем; затем, медленно вращая колесо R, начинают сжатие до тех пор, пока коромысло, опускающееся вместе с верхней частью параллелограмма, не начнет отставать от последнего, что легко подметить, помещая между ними полоску тонкой бумаги в натянутом положении; в этот момент быстро дают колесу обратное вращение. Так как высота цилиндриков всегда = 13 мм, то, измерив остаточную высоту h с точностью до 0,01 мм, находят разность 13 — h, которая и представляет искомое сжатие ε, соответствующее постепенно нарастающей силе Т.
При таком способе тарирования оказалось, что между пределами от 1000 до 3500 килограммов зависимость Т и ε выражается функцией Т = К0 + Кε, где К0 и К постоянные, очень мало изменяющиеся для различных партий цилиндриков, тщательно сделанных: Кс = 541 и К = 535.
| Т | Опыт. ε | Выч. ε | Т | Опыт. ε | Выч. ε | ||||
|---|---|---|---|---|---|---|---|---|---|
| 1000 | — | 0,90 | — | 0,86 | 2500 | — | 3,73 | — | 3,66 |
| 1500 | — | 1,74 | — | 1,79 | 3000 | — | 4,62 | — | 4,59 |
| 2000 | — | 2,67 | — | 2,73 | 3500 | — | 5,49 | — | 5,53 |
Величины Т, очевидно, представляют сопротивления цилиндриков в разных степенях сжатия при данном способе тарирования. Пусть в манометрической бомбе произведен какой-нибудь взрыв. Если бы давление газов P нарастало медленно, так что оно постоянно уравновешивалось сопротивлением цилиндрика крешера, то зависимость P от сжатия ε выразилась бы такой же линейной функцией, как зависимость между Т и ε, и тогда P на всю площадь основания поршня было бы равно Т. Но такое постоянное равновесие существовало бы во всех случаях только тогда, когда давления передавались бы цилиндрику непосредственно; при передаче же этих давлений через поршень вследствие инерции последнего, вообще говоря, в начале взрыва сопротивление цилиндрика выходит менее, нежели давление газов, а к концу взрыва оно увеличивается, и сжатие прекращается, когда полная работа давления газов будет равна работе сопротивления цилиндрика. Изображая (см. рис. 9) найденную выше зависимость между Т и ε графически прямой линией CF, давления газов во время сжатия, вследствие быстрого возрастания их до максимума по другому закону, нужно выразить кривой ОР, обращенной своей вогнутой стороной к оси абсцисс. Так как, согласно вышесказанному, вначале кривая давлений P идет выше линии Т, то вследствие равенства окончательных работ их в последующие периоды сжатия кривая P должна идти ниже Т. Следовательно, при употреблении поршней между Т и P существует только некоторое соотношение, определяемое быстротой возрастания давления и массой поршней. Чем медленнее совершается разложение взрывчатого вещества и чем меньше масса поршня, тем ближе значения Т и P к совпадению и тем меньше отличаются друг от друга обе эти величины, оцениваемые по окончательному сжатию. Наоборот, чем быстрее разложение и чем больше масса поршня, тем выше вначале располагается линия P над линией Т, тем выше идет последняя над первой к концу и, следовательно, тем больше отношение Т/Р. Но пусть имеем крайний случай, когда разложение почти мгновенно и давление газов сразу достигает некоторой величины P, остающейся постоянной во все время сжатия. Тогда соотношение между Т и P выразится графически чертежом (см. рис. 10). Из равенства площадей oacdef и oabcef, выражающих работы, следует, что треугольники abc и ecd равны, т. е. ab = ed и bc = се. Следовательно, of = 2og, и потому в данном случае сопротивление Т, равное df, соответствует сжатию of, вдвое большему, чем сжатие og, соответствующее действительному давлению P, равному cg (при предположении медленного его возрастания). Таким образом, имеем два крайних случая: 1) давление возрастает медленно — тогда оно непосредственно находится по таблице для Т; 2) давление возрастает столь быстро, что его можно считать постоянным во все время сжатия, — тогда оно равно величине Т, соответствующей вдвое меньшему сжатию, чем наблюденное.
Очевидно, при измерениях давлений какого-либо взрывчатого вещества нужно знать, какой из этих двух крайних случаев к нему применяется или имеет место еще некоторый средний случай. Для этого необходимо знать соотношение между быстротой развития максимума давлений τ для взятого взрывчатого вещества и промежутком времени τ0, необходимым для получения сжатия под действием данной постоянной силы, приложенной к цилиндрику без начальной скорости поршня. В самом деле, если последний промежуток τ0 будет значительно менее первого τ (в два раза и более), то, понятно, ни в начале, ни к концу сжатия линия P не отклонится от линии Т, так как тогда поршень, производя сжатие, во всяком случае будет успевать повиноваться давлению газов. Наоборот, если τ сравнительно с τ0 так мало, что его можно считать равным нулю, то это значит, что сжатие производится как бы постоянной силой. Для определения промежутка времени τ0 Сарро и Вьейль, составляя уравнение движения поршня, сжимающего цилиндрик под действием постоянной силы, получили окончательно выражение: т. е. это время не зависит от величины сжимающей постоянной силы, а лишь от массы поршня и величины коэффициента k в функции, показывающей зависимость между Т и ε (или от свойств взятых цилиндриков). Так, при поршне весом в 60 гр. (чаще всего применяемом) и значении К = 535, беря ускорение силы тяжести 9810 мм, вычисляется τ0 = 0,00034 секунды. Что же касается времени τ, в течение которого нарастает максимум давления для взятого взрывчатого вещества, то оно выводится из быстроты сжатия цилиндрика θ, находимой по способу, описанному при рассмотрении скорости горения взрывчатых веществ. Когда отношение более 2, Сарро и Вьейль принимают τ = θ; если же менее 2, то приближенно τ = 2(θ − τ0).
Производя такие определения с поршнем около 60 гр., были найдены следующие результаты. Для обыкновенного пороха в различной степени его измельчения отношение всегда более 2, и потому давления его при различных плотностях заряжания равны Т, соответствующим полному сжатию цилиндриков. Для пироксилина может быть принято равным нулю, т. е. давления его равны Т, соответствующим половине наблюденного сжатия. Для некоторых же веществ, как, напр., для нитроглицерина (в динамите), τ/τ0 получается средним между означенными пределами, а именно 0,76. В таком случае имеет место сложное соотношение между Т и P, но его можно свести к одному из предельных случаев, уменьшая вес поршня или сильно увеличивая его, т. е. изменяя значение τ0; так, для нитроглицерина при поршне в 3,76 гр. равно 2,3, т. е. тогда давление измеряется Т, соответствующим полному ε, а при поршне в 4000 гр. т. е. близко к нулю, и следовательно, давление тогда равно Т, соответствующему 1/2ε. И действительно, при одной и той же плотности заряжания (0,3) с малым поршнем получается сжатие 3,50, а с большим 6,50, т. е. почти вдвое большее.
Следующая таблица содержит в себе данные для трех приведенных взрывчатых веществ (площадь основания поршня 1 кв. сан.):
| Название вещества |
Плот- ность заря- жания |
Состояние вещества |
Время τ в секундах |
Вес веще- ства грамм |
τ/τ0 | Сжатие в милли- метр. |
Давле- ние P в килогр. на 1 кв. с. |
|---|---|---|---|---|---|---|---|
| Обыкновен. порох |
0,70 | Пыль | 0,00165 | 59,7 | 4,80 | 5,70 | 3590 |
| Мелкие зерна | 0,00255 | 59,7 | 7,40 | 5,70 | 3590 | ||
| Кусочки лепешек | 0,00420 | 59,7 | 12,50 | 5,60 | 3537 | ||
| Прессов. кусок | 0,08400 | 59,7 | 251,00 | 5,60 | 3537 | ||
| Пироксилин | 0,20 | Порошок | 0 | 727,7 | 0 | 5,40 | 1988 |
| 0 | 59,7 | 0 | 5,42 | 1988 | |||
| Нитроглицер. | 0,30 | Динамит | 0,00026 | 4000,0 | 0,09 | 6,50 | 2280 |
| — | 59,7 | 0,76 | 5,50 | — | |||
| — | 3,76 | 2,30 | 3,50 | 2412 |
Давления, отвечающие более высоким плотностям заряжания, находятся вычислением, определяя закон их изменения при малых плотностях, допускающих опыты в бомбах. Если взрывчатое вещество сполна превращается в газы, то отношение (где Δ — плотность заряжания) чувствительно представляет линейную функцию: где f и b постоянные. Такая же зависимость замечается и для веществ, дающих при взрыве твердые нелетучие продукты; нужно только при расчете плотности заряжания вместо отношения между весом заряда и объемом камеры взять отношение части заряда, соответствующей газам, к емкости камеры, уменьшенной на объем твердых продуктов. Очевидно, вопрос сводится к измерению давлений при нескольких постепенно возрастающих Δ. Возьмем, напр., пироксилин. Сарро и Вьейль для него получили следующие данные:
| Δ | ε | Р | Р/Δ |
|---|---|---|---|
| 0,10 | 1,50 | 942 | 9420 |
| 0,15 | 3,42 | 1458 | 9720 |
| 0,20 | 5,40 | 1989 | 9945 |
| 0,25 | 7,7 | 2574 | 10296 |
Откуда, изменение по Р выражается уравнением прямой по которому можно вычислить Р и при больших плотностях заряжания; напр., при Δ = 1,00 (для прессованного вещества) Р = 15700 килограммов на 1 квадратный сантиметр. Но легко видеть, что вычисляемые таким образом давления при больших плотностях заряжания будут только более или менее приближаться к действительным, так как величина их при значительных Δ в сильной степени зависит от величины коэффициента b (т. е. наклона прямой к осям координат), который, в свою очередь, определяется точностью самих опытных данных[4]. Кроме того, необходимо заметить, что эти давления отвечают в каждом данном случае известной средней величине их, могущей в некоторых точках общей массы газов сильно увеличиваться или уменьшаться, так как в действительности газы, почти мгновенно образовавшиеся, представляют как бы нити материи в состояниях сжатия, весьма различающихся между собой, чего доказательством могут служить вдавления, бороздки и другие отпечатки, получающиеся при детонации на прочных металлических плитах.
Нахождение давлений вычислением предполагает, что состав газов при максимуме температуры тот же, как и после охлаждения; что температура их вычислена близко к действительности и, наконец, что законы изменения их упругости с плотностью и температурой известны. Пусть 1 килогр. газов занимает при нормальных условиях V0 литров, и положим, что мы заключили их в камере объема v литров и сообщили температуру t°. Если бы они были идеальные газы, т. е. строго повиновались законам Мариотта и Гей-Люссака, то давление их равнялось бы означая через R, (273 + t) — через Т (абсолют. темпер.), через Δ (плотность газов), это выражение принимает вид P = RTΔ. В применении к килограмму взрывчатого вещества, сполна превращающегося в газы, R и Т суть постоянные для него, Δ же — плотность заряжания. Но действительные газы не следуют строго законам Мариотта и Гей-Люссака, так как они представляют системы материальных частиц, занимающих известный объем и претерпевающих некоторое взаимное притяжение, притом — величины этого объема и притяжения для различных газов неодинаковы. Принимая во внимание оба приведенные фактора и выражая давление в килогр. на 1 кв. сант., Ван-дер-Ваальс вывел следующее уравнение: в котором величина а характеризует меру притяжения газовых частиц (она обратно пропорциональна квадрату емкости камеры), b служит мерой объема их. Клаузиус заменил это уравнение другим, более точным и в то же время более удобным для вычисления давлений: в котором значения а и b те же самые, но а принимается изменяющимся обратно пропорционально Т и квадрату суммы с + d, представляющих новые две постоянные. Оба члена уравнения Клаузиуса применяются лишь при очень точных вычислениях; для приближенных же вычислений давлений, развиваемых взрывчатыми веществами, достаточно пользоваться упрощенным выражением т. к. вторым членом, по его сравнительно малой величине, можно пренебречь. При расчетах вместо v удобнее вводить Δ, так как Деля числитель и знаменатель на получим Следовательно, чтобы найти давление какого-либо вещества при данном Δ, нужно: 1) вычислить RT (причем R находится по формуле ); 2) определить величину b, характеризующую объем газовых частиц. Эта величина, представляющая некоторую вообще весьма малую, часть общего объема газов, взятых при нормальных условиях, по расчетам Сарро (С. R. t. 94, р. 639, 718, 845), для H2, N2, O2, СО, СО2, СН2 и С2Н4 изменяется от 0,00089 до 0,00136. Малляр и Ле Шателье принимают ее одинаковой для всех газов, а именно 0,001. Величины RT и b, очевидно, суть характерные для каждого В. вещества; первая определяет сравнительную силу его, а вторая — большее или меньшее отклонение от простой пропорциональности давлений с плотностью заряжания, или наклон прямой, выражающей графически функцию по P, так как выражение приводится к виду .
Вычисленные указанным способом давления при малых плотностях заряжания довольно удовлетворительно согласуются с опытными величинами, как это показали Малляр и Ле Шателье для многих взрывчатых веществ («Mémoriales des poudres et salpêtres», t. II); напр. для пироксилина получаются: t = 2660°, RT = 9530, b = 0,860, при Δ = 0,2, P = 2300 килогр.; опытное же Р = 1989 килогр. Но при более значительных Δ вычисление приводит, во всяком случае, к слишком большим величинам[5].
В способе вычисления давлений заключается немало гипотетического, и в настоящее время для нахождения их может служить главным образом опытный путь. Как бы то ни было, однако, очевидны сами собой следующ. выводы.
1) Так как давления пропорциональны плотностям заряжания, а в зарядную камеру нельзя положить больше известного количества, определяемого плотностью самого взрывчатого вещества, то самые большие давления должны получаться для веществ, спрессованных до высокой плотности или по своей природе обладающих большим удельн. весом. Гремучая ртуть в прессованном состоянии потому и дает наиболее высокие давления, что, сполна превращаясь в газы, обладает плотностью 4,42. В самом деле, если сравнить давления ее с давлениями пироксилина при соответственно малых плотностях заряжения, то они являются значительно меньшими, но зато в то время как предельный объем газов пироксилина не отличается значительно от его собственного объема (при наибольшей плотности = 1), такой же объем газов гремучей ртути по крайней мере в 1,6 раз больше ее объема в прессованном состоянии (ибо предельная наибольшая плотность паров ртути не более 13,59, азота же с окисью углерода не более 1); откуда при взрыве в собственном объеме прессованная гремучая ртуть должна развить давление далеко выше всякой измеряемой величины, пироксилин же дает давления, почти доступные мере.
2) Так как давление пропорционально RT, то и при небольшой плотности взрывчатые вещества могут развивать громадные давления, если они способны давать большой объем газов с малой теплоемкостью и выделять при этом огромное количество тепла[6].
Значение объема газов и количества отделяющегося тепла для величины давлений взрывчатого вещества настолько преобладает, что в прежнее время, когда сведения о газах при высоких температурах и давлениях не существовали, Бертело предложил сравнивать различные вещества в отношении развиваемых давлений при помощи произведений V0Q, названных им характеристическими. В самом деле, величины RT почти пропорциональны этим произведениям для веществ, имеющих сходственный состав, т. е. дающих продукты, близкие по своей теплоемкости. Если же состав взятых веществ не аналогичен, то при сравнениях означенные произведения необходимо было бы брать в виде при грубых сравнениях последними продолжают пользоваться и до сих пор.
IX. Работа В. веществ. При взрывах всякую оболочку заряда можно рассматривать более или менее как адиабатическую (не отнимающую и не отдающую тепла). Пусть 1 килогр. взрывчатого вещества сполна превращается в газы с развитием при этом абсолютной температуры Т, в вертикальном цилиндре с поршнем, и пусть газы, расширяясь вверх, преодолевают давление, постоянное или переменное. Тогда, очевидно, производится некоторая внешняя работа и вместе с тем температура газов понижается по закону сохранения энергии. Если обозначим количество тепла, теряемое газами при охлаждении их на 1°, через С, а элемент внешней работы, соответствующий изменению температуры на dT, через pdv, то по основному уравнению механической теории тепла получим: и
Произведение EQ, где E означает механический эквивалент тепла, а Q — теплоту, отделяемую при абсолютном нуле, выражает всю возможную работу независимо от каких-либо перемен в состоянии газов (физических или химических) в течение всего процесса, а также от изменения C с температурой. Но это — предельная работа, в действительности никогда не развивающаяся, между тем как для более полного изучения В. В. и их применений представляет особенный интерес определение действительной работы в каких-либо данных условиях.
Следующий прием определения действительных работ может послужить к более полному, чем доныне, изучению предмета [7].
Если во время процесса не происходит диссоциации газов и если давление окружающей среды настолько велико, что газы перестают расширяться ранее, чем начнется сгущение части их вследствие охлаждения, то такая система может быть уподоблена какому-нибудь постоянному газу, испытывающему адиабатный процесс, а следовательно, принимая за единицы килограмм и метр, действительная работа выразится уравнением: в котором R1 = 10 x R (вследствие принятия метра вместо дециметра за линейную единицу), величина k есть отношение теплоемкостей при постоянном давлении и постоянном объеме, v1, v2 — начальный и окончательный объемы газов. Это уравнение отличается от обыкновенного, выводимого в механической теории тепла для совершенных газов, только тем, что в нем взято отношение вместо с целью принять во внимание объем частиц газов. Очевидно, опытное определение действительных работ сводится к измерению в каждом случае объемов v1 и v2. Чем меньше давление окружающей средины и чем больше окончательный объем v2, тем значительнее действительно произведенная работа.

Представим себе, что газы различных взрывчатых веществ производят работу, увеличивая объем камеры в однородных по величине и свойствам свинцовых цилиндрах, подобных предложенным Абелем для первичного сравнения силы взрывчатых веществ. Нижеописанным способом эти цилиндры можно так приспособить, что о работе, произведенной внутри их при взрыве какого-либо вещества, можно прямо судить по увеличению зарядной камеры. В свинцовом цилиндре (см рис. 12), которого высота и диаметр = 20 сант., имеется цилиндрическая камера емкостью (после вставления пробки) 31 куб. с. Уничтожение прорыва газов через пробку достигается следующим приспособлением. Верхняя часть бомбы укрепляется стальным кольцом SS, надеваемым перед опытом; на оба основания накладываются стальные круглые плитки а и b; все вместе зажимается, возможно туго, с помощью винта, в железной раме Z, как показано на чертеже. Воспламенение производится электричеством посредством капсюля с гремучей ртутью; проводники выводятся наружу через тонкое отверстие в пробке. При взрыве свинцовая пробка совершенно сливается со свинцом бомбы, образуя одну сплошную оболочку, и тем самым уничтожает всякий прорыв газов наружу; звук взрыва весьма слабый. Сделав сверлом отверстие и выпустив газы, определяют окончательный объем камеры по количеству вмещающейся в ней воды. Внутренние стенки после взрыва остаются всегда гладкими, камера имеет почти шарообразную форму; внешний вид бомбы изменяется, как показано на чертеже. Производя определение отношения между конечным объемом камеры v2 и работами W c помощью взрывов пироксилина, были получены результаты, выражаемые уравнением: W = 2282 + 5,902(v2 − 385) − 0,00014(v2 − 385)2, причем вычисление работы, соответствующей какому-нибудь v2, полученному в опыте, производилось следующим образом: напр. 10,9 гр. сухого пироксилина + 2 гр. гремучей ртути (в запале) дали среднее v2 = 385 к. с. Для 1 килограмма такого заряда (содержащего 0,845 пироксилина и 0,155 гремучей ртути) R1 = 29,152, а для 0,0129 кил. r = 0,3761; Т = 2990°; rT = 1124; Δ = 0,416; = 0,0709; Cv = 0,339. Для определения k нужно найти теплоемкость при постоянном давлении Ср; она больше Cv на тепловой эквивалент внешней работы, производимой 1 килогр. газов при нагревании на 1°. Рассуждая, как при вычислении Qp и Qv, найдем, что для газов пироксилина этот эквивалент равен = = 0,0765, т. е. Ср = 0,415; откуда k = 1,21 и W = 2282.
Прилагаемая таблица показывает степень согласия W, вычисленных по найденному уравнению и полученных из опытов:
| v2 | W опытн. | W вычисл. | Вес зар. в грамм. |
|---|---|---|---|
| 385 | 2282 | 2282 | 10,9 пир. + 2 гр. рт. |
| 693 | 4069 | 4087 | 17,0 |
| 842 | 4968 | 4951 | 20,0 |
| 1170 | 6894 | 6833 | 25,84 |
| 1405 | 8100 | 8146 | 29,1 |
Точно такое же отношение между v2 и W получилось при определении с помощью взрывов гремучей ртути.
Сравнение действительных работ с возможными, вычисленными по количеству отделяющегося тепла, показывает возрастание пропорции тепла, превращаемого в работу, с увеличением v2, что и понятно, так как с расширением бомбы давление ее стенок уменьшается.
Определение действительных работ В. веществ с помощью описанного способа может дать важные указания о температуре газов, их состоянии и т. п. Напр. этим путем находится температура взрыва нитроглицерина гораздо выше, чем вычисляемая по формуле Малляра и Ле Шателье: 13,5 гр. его + 2 гр. гремучей ртути дают v2 = 805 к. с. Этому v2 по выше данному уравнению отвечает W = 4837 килограммометров. Для взятого заряда значения: r = 0,388; k = 1,24; b = 0,27. Подставляя эти величины в уравн. работы, имеем: откуда T = 5516°, а по Малляру и Ле Шателье для динамита она около 3000°.
Действительно производимые работы играют большую роль в применениях взрывчат. веществ для стрельбы, но рассмотрение этой стороны дела завлекло бы нас далеко в сторону; подробное изложение сюда относящихся сложных вычислений находится в мемуарах Сарро, Сен-Робера, Нобля и Абеля, Себера и других ученых, занимавшихся баллистикой. Для практического сравнения взрывчатых веществ достаточно ограничиться только вышеозначенными возможными работами их. Очевидно, они пропорциональны абсолютным количествам тепла; но в практике отношения таких теплот можно заменить приближенными отношениями теплот, отделяемых взрывчатыми веществами при обыкновенной температуре. В самом деле, те и другие отличаются между собой только на то небольшое количество тепла, которое содержится в газах при обыкновенной температуре и которое равно произведению теплоемкости их на обыкновенную температуру, переведенную в абсолютную (считаемую от абсолютного нуля = −273° Ц.). Следовательно, чтобы сравнить способности взрывчатых веществ производить механическую работу, нужно знать только количества теплоты, развивающейся при их разложении, способы для нахождения которых были изложены выше.
Но в настоящее время, исходя из нижеследующих теоретических соображений, мы можем прямо сказать, в каком случае теплоты разложения будут наибольшие, а также вообще далее чего не могут простираться наши стремления в этом отношении (по крайней мере при существующем запасе сведений). Известно, что самые большие тепловые выделения получаются при горении простых тел (или некоторых их соединений) в кислороде. Сравнение этих выделений, отнесенных к 1 килогр. получающихся окислов, показывает, что водород, углерод и сера относятся к числу элементов, сгорающих с наибольшим отделением тепла:
| Н2О | +3810 кал. | SO3 | 1290 кал. |
| СО2 | +2200 | SO2 | 1110 |
| СО | +1060 |
Так как техника уже воспользовалась горением этих тел для приготовления взрывчатых веществ, то, очевидно, теория с ней вполне согласна; других более пригодных элементов нет. Но это только исходная точка вопроса.
Водород, углерод и сера, взятые в смеси с кислородом, в свободном состоянии неудобны для употребления. Мы принуждены брать их (все или только некоторые) в виде известных соединений, твердых и жидких. При этом можно себе представить два случая: или эти соединения образованы с отделением тепла, или наоборот — с поглощением оного. В последнем случае, очевидно, взрывчатое вещество отделило бы (при всех прочих одинаковых условиях) еще больше тепла, чем при употреблении свободных элементов. Но вследствие необходимости вводить в весовую единицу вместе с кислородом посторонние тела (N, К, Cl и т. п.) увеличение теплового эффекта этим путем на самом деле не достигается. С другой стороны, если бы даже и мыслимо было такое увеличение, то его возможно будет осуществить разве только в будущем, с развитием сведений об эндотермических соединениях; пока же мы не имеем здесь никакой почвы.
Таким образом, практика принуждена ограничиться главным образом другим из вышеупомянутых случаев — употреблением экзотермических соединений, каковыми и являются все важнейшие современные взрывчатые вещества. Помимо введения в весовую единицу вместе с кислородом посторонних элементов, понижение теплового эффекта при взрыве здесь условливается еще тем, что элементы при образовании взрывчатого вещества теряют часть своей энергии. В обыкновенный порох кислород вводится в виде селитры, теплота образования кот. +118,7 кал. Образование нитроглицерина дает место следующим тепловым выделениям:
| С3 + H8 + О3 = С3Н5(OH)3 | +165,5 кал. |
| 3(H + N + O3) = 3HNO3 | +41,6 × 3 = 124,8 к. |
| С3Н5(OH)3 + 3HNO3 = С3Н5(NO3)3 + 3Н2О | +4,7 × 3 = 14,1 кал. |
| Сумма = +303,4 кал. |
Вычтя из 303,4 кал. теплоту образования 3Н2О (207 кал.), найдем, что затрата энергии элементов при образовании С3Н5(NO3)3 в итоге равняется + 96,4 кал. Очевидно, высшим пределом тепловых выделений, к которому всевозможные современные взрывчатые вещества могут более или менее приближаться, но никогда не достигать, будут теплоты сгорания свободных водорода и углерода в свободном же кислороде. Большие или меньшие отступления от этого предела будут определяться:
а) пропорцией посторонних элементов, входящих в весовую единицу вещества;
в) отношением количеств горючих элементов и кислорода;
с) теплотой образования взрывчатого вещества из элементов.
Сделаем еще один шаг в таких теоретических рассуждениях. В различные взрывчатые вещества кислород вводится через соединение соответственных тел с азотной кислотой; но при этом соединении могут затратиться различные количества энергии простых тел. Образование селитры, входящей в состав обыкновенного пороха, соответствует очень сильным сродствам и сопровождается большим отделением тепла
КНО (тверд.) + HNO3 (безводная) = KNO3 (тверд.) + Н2О (жидк.)… 43 кал.
Наоборот, соединение азотной кислоты с алкоголями при образовании азотных эфиров сопровождается незначительными тепловыми эффектами («An. de Chimie et de Phys.», 5-е série, t. 9, p. 316):
С3H5(OH)3 + 3HNO3 = С3H5(NO3)3 + 3Н2О + 4,7 × 3 кал.
C6Н8(OH)6 + 6HNO3 = C6H8(NO3)6 + 6H2O + 3,9 × 6 кал. и т. п.
Теплоты нитрации т. н. ароматических соединений занимают промежуточное место, а именно — при замене в них каждого пая водорода нитрогруппой выделяется +36,5 кал. Но чем менее выделяется тепла при введении каждого пая азотной кислоты, тем больше энергии первоначальных прост. тел сохраняется в получающихся соединениях, а следовательно — тем больше отделится теплоты при взрыве последних. Очевидно, в азотных эфирах сохраняется большее количество начальной энергии элементов.
Самые же большие количества тепла должны отделяться при взрыве таких жидких веществ, как смеси различных углеродистых веществ с дымящейся азотной кислотой или жидким азотноватым ангидридом, потому что при образовании механической смеси или растворов потеря энергии составными частями еще менее, чем при образовании азотных эфиров.
Статья проф. И. М. Чельцова, как автора весьма полного практического и научно-теоретического труда «Взрывчатые вещества» (1880—1884), написанного для офицеров минных классов, и как ученого, посвятившего давно свою деятельность теории и практике В. веществ, знакомит читателей «Энцикл. словаря» лишь с долей тех обширных современных интересов, которые связаны с изучением В. В. На первый взгляд может показаться, что масса ученых, занятых ныне во всех странах разработкой этого предмета, интересовавшего еще недавно одних чисто профессиональных деятелей (артиллеристов и пороховых техников, напр. ingénieurs des poudres et salpêtres — французов), работает для маленькой ветви техники, утрачивая из-за того другие, высшие научные и общественные интересы и напрасно подвергаясь притом риску, сопряженному всегда с изучением В. веществ. Но такая видимость несогласна с действительностью. Не стоит упоминать ни о том, что первый приступ химико-физических знаний к делу В. В. привел к замене черного и дымного пороха совершенно новыми его видами, ни о том, что всеобщая воинская повинность, ставшая действительно всеобщей, легла и на людей науки, обязывая их внести свою дань в защиту мира, ни о том, что гражданские применения взрывчатой силы увеличиваются ежедневно, по мере того как развивается промышленность [8]; остановимся лишь на двух сторонах предмета, показывающих, что привлекает мирных ученых к делу изучения В. В. 1) Обычные физические и химические явления, легко подлежащие изучению, совершаются чаще всего в условиях малых давлений и невысоких температур; наши сведения о веществе этими условиями сильно ограничиваются, а между тем, как внутри земли и солнца, так и во множестве других обстоятельств вещество находится (единовременно) именно в таких условиях высокой температуры и сильного давления, в которых естествоиспытателям нельзя производить свои наблюдения. Взрывчатые же вещества доставляют совокупность условий сего рода с чрезвычайной легкостью. Изучение их едва началось, путь лишь едва намечен, а при развитии исследований В. В. дадут, без сомнения, множество новых опытных данных для естественной философии, что и возбуждает научных деятелей углубляться в область этого предмета. А так как здесь дело идет о газах, то есть о таком состоянии вещества, которое наиболее поддалось современному изучению химиков и физиков, то внимание к В. В., вероятно, год от года будет не умаляться, а возрастать, ибо в новой области этого предмета предвидится множество самостоятельных и глубоко важных для науки вопросов. 2) Не подлежит сомнению, что введение общераспространенного пороха, найденного почти случайно — китайцами и монахами, настолько урегулировало дело войны, что войны стали реже потому, что вместо действия с преобладанием единиц (довольно вспомнить Ахиллесов и Гекторов) наступила пора действия организованных масс и личные внешние качества стали на второй план, так как сражающиеся удалились друг от друга на расстояние, определяемое гибельностью огнестрельного оружия [9]. И чем дальше будут стрелять ружья и пушки, тем, без всякого сомнения, войны будут реже, а когда, что ныне уже очень близко — по времени, ружья будут бить на расстояниях, при которых не видно стрелка и не слышно выстрела, тогда, с одной стороны, каждому будет виднее, чем доныне, лотерейность войн, а с другой стороны, станет нагляднее выступать и в этом деле значение знания, разумности, предусмотрительности и гуманности, которые прекратят войны. Эти соображения ведут к тому заключению, что изучение В. В. и усовершенствование силы огнестрельного оружия — один из лучших и верных путей к достижению общего мира. Имев надобность вникнуть в этот предмет и случай узнать в этом отношении мнение многих передовых людей и будучи сыном своей страны, которой нельзя не пожелать вечного мира, я не обинуясь говорю: что изучение В. В. имеет, между прочим, целью — упрочение всеобщего мира, что охота воевать обратно пропорциональна по крайней мере квадрату (если не кубу или еще высшей степени) расстояний или дальности боя оружия, что, закономерно управляя скоростью горения В. В. и увеличивая начальную скорость выкидываемых снарядов, современность содействует высшим сторонам просвещения и прогресса и что разработка знания В. В. отвечает как прямым, так и косвенным целям мирных успехов науки и промышленности.
Опасность, представляемая В. веществами, вызывает особые, издаваемые в законодательном порядке правила, которые имеют своей задачей: 1) усилить наказуемость преступлений, для совершения коих употреблены были В. вещества, и 2) предотвратить возможность несчастных случаев и злоумышлений путем строгой регламентации производства, хранения, перевозки и продажи этих веществ. Уложение о наказаниях 1845 года впервые установило особый вид общеопасных преступлений — взрыв, и определило, что виновные в умышленном истреблении или повреждении какого-либо чужого имущества взрывом пороха, газа или иного удобовоспламеняющегося вещества подвергаются самой высшей мере наказаний, определенных за поджог (ст. 1616 Улож. о наказ. по изд. 1885 г.). В новейшее время чрезвычайное развитие техники В. веществ привело к изданию целого ряда правил, преследующих, главным образом, вторую из намеченных задач. Прежде всего 6 мая 1874 г. утверждены были особые правила «О торговле охотничьим порохом, перевозке и хранении пороха» («II-е Полное Собрание Законов», № 53480; ср. ст. 986, 9861, 9862 Улож. о нак., изд. 1885 г.), а 22 мая 1876 г. высочайше утверждено было мнение Государственного совета «По проекту правил о частных пороховых заводах», давшее материал для 13501 ст. Улож. о наказ. (изд. 1885 г.); дополнением к этому служит высочайше утвержденное 15 ноября 1883 г. мнение Государственного совета «О частных заведениях для приготовления капсюлей к охотничьему оружию», отразившееся в Уложении о наказаниях статьей 13502. Вследствие широкого применения, какое в новейшее время получили в горном деле В. вещества, отличающиеся своей особой разрушительной силой, изданы были на этот предмет подробные правила. 22 февраля 1880 г. высочайше повелено было: предоставить министру государственных имуществ утвердить временные правила об употреблении В. веществ при горных работах и при том установить и сами наказания за нарушение этих правил применительно к правилам 6 мая 1874 г. об охотничьем порохе; затем 11 мая 1882 г. изданы были уже в законодательном порядке «Временные правила о частных складах взрывчатых веществ для надобностей горнозаводской и соляной промышленности», приложенные к примеч. 2 ст. 1474 Устава горного («Свод Закон.», т. VII, по продолж. 1886 г.). Согласно этим правилам, к В. веществам отнесены: минный (горный) порох всех родов, гераклин, пироксилин, динамит, всякие нитроглицериновые и друг. препараты, состав и свойства коих в практическом применении точно известны, а также необходимые для производства взрывов принадлежности. Устройство складов всех этих веществ разрешается частным лицам в тех местностях, где существует горнозаводская и соляная промышленность. В складах этих не должны быть хранимы нитроглицерин, гремучая ртуть и всякие взрывчатые препараты, состав и свойство коих в практическом применении точно не известны. Минный порох и гераклин разрешается хранить лишь в особых для них устроенных складах, отдельно от других В. веществ. Вещества, хранимые в складах, могут быть отпускаемы только таким лицам, которые представят особое свидетельство, выдаваемое горным начальством на каждую отдельную покупку. Порядок открытия, устройства и содержания склада определяется особыми правилами, нарушение коих влечет ответственность по 9863, 987 и 9891 ст. Улож. о наказаниях изд. 1885 г. и по ст. 118 устава о наказаниях, налагаемых мировыми судьями (изд. 1885 г.).
Примечания
править- ↑ О применении В. веществ, кроме статей о пушках, ружьях, минах и т. п. военных приспособлениях, в «Энциклопедическом словаре» говорится в статьях: Взрывные работы (туннелей и т. п.), Газовые двигатели, Горное дело, Соль, Запалы, Патроны и друг. Нельзя не упомянуть о том, что с 1891 г. В. вещества обещают получить на основании американских опытов новое приложение — для вызова дождя. Предмет этот доныне еще вовсе не обследован, писать о нем еще нельзя ни в утвердительном, ни в отрицательном смысле; но не существует, по мнению моему, никакой невозможности в вызове дождя при помощи взрывов, произведенных на некоторой высоте в атмосфере, потому что взрывы производят волны сгущения и разрежения, причем в поясе разрежения могут получаться из влаги воздуха дождевые осадки и происходить такие смешения слоев воздуха, имеющих различную температуру и относительную влажность, что достигается точка росы и, следовательно, наступают известные условия для образования дождевого осаждения. Известно, что в сухом сосуде (напр. графине), содержащем обыкновенный влажный воздух, при быстром разрежении воздуха (напр. ртом, плотно прижав губы) происходит туман и что громовые тучи часто выливают такое количество воды, которое, несомненно, не могло содержаться в туче, а происходит от сжижения влаги, находящейся в воздухе и близкой к точке росы, т. е. туча несет условия дождеобразования, а не саму массу выливающейся воды, как проследил, напр., Мон в грозах Норвегии (см. «Метеорология» Мона). Нельзя также отрицать возможности происхождения электрической энергии при взрывах и участия этой энергии в образовании дождя. Соображения этого рода допускают возможность вызова взрывами дождя при известном сочетании благоприятных условий, но предмет этот, как и все явления дождеобразования, еще требует многих научных работ, направленных в сторону покорения действующих здесь сил природы на службу человечеству. Если В. вещества помогут в этой победе, как помогают они уже ныне преодолевать твердыню горных хребтов, то они, как сталь уже ныне, в будущем послужат на такую пользу, что искупят ту массу зла, которая совершалась не раз при посредстве В. веществ. Предлагаемая читателям «Энциклопедического словаря» статья проф. Ив. Мих. Чельцова покажет, что научное знание В. веществ подвинулось за последнее время весьма значительно вперед, а это дает полную уверенность в том, что полезные применения В. веществ станут возрастать на службу достижения возможного общего мирного благополучия.Д. Менделеев.
- ↑ а б Согласно уравнению разложения Дебуса.
- ↑ По-видимому, употребляя вместо гремучих газовых смесей твердые и жидкие взрывчатые вещества, разлагающиеся совершенно определенным образом, можно было бы получить более точные величины средних теплоемкостей обыкновенных газообразных продуктов взрыва, так как при этом вследствие огромных давлений диссоциацией действительно можем пренебречь, и с другой стороны, охлаждение происходило бы в меньшей степени. Напр. из опытных данных Сарро и Вьейля относительно давлений, развиваемых гремучей ртутью, нитроглицерином, нитроманнитом, азотно-аммиачной солью и другими подобными веществами, получаются следующие результаты: частичные теплоемкости СО, N2, Н2, О2 и т. п. при возрастании t до 2000° увеличиваются до 6 (около) и сохраняют это значение при дальнейшем изменении t до 5000°, частичные теплоемкости Н2О и СО2, постепенно возрастая, достигают 16 (около) при 2000° — 2500°, а затем начинают падать, стремясь к 9 (около) по мере приближения к 5000°. П. С. Курнаков («Журнал Р. Ф.-Х. Об.», т. XXII, стр. 492), при перечислении кажущихся теплоемкостей СО2, данных Бертело и Вьейлем, на действительные, показал, что после 2000° величина их начинает падать, для этого нужно было только принять во внимание коэффициенты диссоциации этого газа, согласно выводам Ле Шателье.
Ч.
- ↑ Так как при вычислениях давлений, отвечающих очень большим плотностям заряжания, приходится прибегать к отдаленному эксполированию, то до получения возможности непосредственного их измерения трудно судить о степени приближенности вычисляемых величин. При содействии моряков-офицеров, плававших на лодке «Мина» в 1889 году, мной были сделаны попытки к такому именно прямому измерению давлений прессованного пироксилина при подводных взрывах. Подобные опыты делались в широких размерах еще ранее в Америке Абботом, который (см. рис. 11), привязывая заряды в центре массивных металлических колец и снабжая кольца по окружности крешерами, обращенными поршнями к центру, определял силу В. веществ при передачи ее через воду.

Рис. 11. Кольцо Аббота для подводных взрывов. В центре привязан заряд. По окружности укреплены 6 крешеров. Но, с одной стороны, употребление свинцовых цилиндриков вместо медных, с другой — неполнота изучения самого действия силы на крешеры при подводных взрывах не позволяли сделать какие-либо определенные выводы из этих опытов и приводили даже к противоречивым заключениям. В моих опытах употреблялись подобные же кольца с зарядом в центре, которые подвешивались в горизонтальном положении, с помощью плавучих буйков и прикрепленных к ним проволочных тросов, на большой глубине, но в крешерах были взяты обыкновенные медные цилиндры, и, кроме того, выработан был сам способ измерений с помощью их при подводных взрывах.
При подводных взрывах несомненно возбуждается в окружающей воде волнообразное движение, т. е. передача энергии на расстояние через ряд последовательно возникающих концентрически сжатых слоев. Так как вода обладает ничтожной сжимаемостью, то плотность образующихся газов можно принять равной плотности заряжания. Примем еще для простоты рассуждений, что пространство, занимаемое газами, имеет шарообразную форму. Из сущности волнообразного движения выводятся следующие положения:
1) Если взяты два заряда одного и того же взрывчатого вещества и при одной и той же плотности заряжания, но различного объема, а следовательно и веса, то количество энергии, сообщаемое прилегающему слою на единице поверхности, постоянно и не зависит от веса заряда. В самом деле, эта энергия дается положительной работой газов, которая в данных условиях выражается произведением давления их на сжатие прилегающего слоя воды, но и давление и сжатие для обоих зарядов, очевидно, одинаковы.
2) На всех сферах, последовательно передающих энергию, общее количество последней остается одно и то же, а следовательно, на единице поверхности убывает обратно пропорционально квадратам радиусов этих сфер или расстояний от центра заряда. Отсюда для двух зарядов с радиусами r и r1 при расстояниях в окружающей воде (от центра) R и R1 на единице поверхности сфер будут равные энергии, если ибо, обозначив энергии на единице поверхности в ближайшем к зарядам слое соответственно через Еr и Еr1, а энергии на взятых расстояниях через ER и ER1, получим: и Но по условию, а Еr и Еr1 по положению (1); след. и ЕR = ЕR1. Другими словами — выражая расстояния в радиусах заряда через энергия убывает обратно пропорционально d2 и для данного взрывчатого вещества в данной плотности заряжания не зависит от веса его.
3) Если выразить энергии Er и ЕR через и то и Но импульсы сил (давлений) в слоях r и R равны prt = mvr и pRt = mvR, где р — давление и t — время, откуда Следовательно, давления в воде будут убывать просто обратно пропорционально расстояниям и при выражении последних в радиусах заряда также не будут зависеть от веса взрывчатого вещества. Другими словами: обозначив на расстояниях d, d1, d2… давления через р, р1, р2…, получим равные произведения pd = p1d1 = p2d2…
4) Энергия, сообщаемая каждому слою при волнообразном движении, делится на две равные части — кинетическую и потенциальную. Вследствие этого на единице поверхности какой-либо сферы получится давление в два раза меньшее сравнительно с тем, какое имело бы место, если бы такого деления не происходило.
Из этих положений следует: давление газов заряда (Р) равняется давлению (р) в какой-либо точке окружающей воды, умноженному на удвоенное расстояние (d), т. е. P = 2pd. Таким образом, при измерении громадных давлений в воде их можно сделать для наших измерительных приборов как угодно малыми, увеличивая d. Но употребление крешеров с этой целью здесь требует другого толкования показаний их сравнительно с бомбами.
При прохождении шарообразных волн через крешеры, укрепленные в кольце Аббота, максимум давлений водяных частиц действует в течение такого бесконечно малого промежутка времени, что поршни крешеров не успевают произвести соответственного сжатия медных цилиндриков. Что это действительно так, доказательством служит изменение сжатия при одних и тех же условиях, в зависимости только от веса поршней. В самом деле, по мере уменьшения этого веса сжатия увеличиваются по гиперболической кривой: где S — вес поршня, А и В — постоянные, а это значит, что предельное сжатие будет иметь место при приближении S к нулю или когда давления стали бы действовать на цилиндрики непосредственно. Теория крешеров показывает, что тогда при графическом изображении линия сопротивлений Т и линия давлений Р совпадают, а следовательно, вычислив ε при S = 0, искомые Р должны равняться Т, соответствующим полному ε. Очевидно, в каждом данном измерении дело сводится главным образом к определению постоянных гиперболической кривой, что и достигалось, сообщая поршням крешеров различный вес. Так, производя взрывы 476 гр. сухого пироксилина при Δ = 1,09 в кольце, у которого радиус до поршней крешеров = 34,5 сант., были получены в зависимости от веса S поршней следующие средние из трех опытов сжатия ε:
S = 31 — 56 — 88 — 115 гр.
ε = 2,77 — 2,20 — 1,77 — 1,53 мм.
Откуда ε = 250/(S + 70), а при S = 0 ε = 4,00 мм. Такому сжатию соответствует давление 2680 килогр. на все основание каждого поршня, которое было 2,36 кв. сант., следоват., на 1 кв. сант. P равно 1136 килогр. Для нахождения давления газов заряда на прилегающий ближайший слой воды нужно знать еще d = R/r, где R есть радиус кольца до поршней (34,5 сантим.), r — радиус шара, равного объему заряда, = 476/1,09; откуда d = 7,35. Таким образ., давление газов пироксилина Р при Δ = 1,09, равно 1136 x 7,35 x 2 = 16698 килогр. на 1 кв. сант. С прессованным пироксилином были сделаны подобные опыты и в других кольцах. В кольце с R = 63,5 сант. и с теми же крешерами заряд в 698 гр. сухого прессованного пироксилина при Δ = 1,00 и d = 11,54 производил сжатия, выражаемые формулой ε = 151/(S + 89); откуда при S = 0, ε = 1,70 мм и давление газов Р = 614 x 11,54 x 2 = 14170 килогр. на 1 кв. сантим. В кольце с R = 13,35 сант. заряд прессованного пироксилина в 63,6 гр. при Δ = 1,06 и d = 5,52 дал: откуда (при S = 0, ε = 5,33 миллим.) P = 1438 x 5,52 x 2 = 15876 килогр. на 1 кв. сантим. Все эти величины Р при столь больших плотностях заряжания довольно близко отвечают находимым по формуле P/Δ = 9170 + 0,416 Р.
Ч. - ↑ Причина неприменимости формул Малляра и Ле Шателье для больших плотностей заряжания, по-видимому, лежит в принятии слишком высокого объема частиц газов или того предельного объема, когда они, подобно жидкой воде, делаются почти несжимаемыми. Допустим, в самом деле, что этот объем равен 0,0004 начального объема, тогда лучше удовлетворяются опытные данные не только при малых плотностях заряжания, но и при столь больших, какие имели место при вышеописанных подводных взрывах пироксилина, притом — не только для этого В. вещества, но и для других. Напр., по отношению к пироксилину имеем:
Δ = 0,20 Р(выч.) = 2058 Р(опыт.) = 1989 = 1,00 » 14568 » 14170 = 1,09 » 17000 » 16698 Хотя и возможно себе представить некоторое уменьшение величины b с температурой, так как по гипотезе здесь подразумевается собственно объем газовых частиц, окруженных сферами, входя в которые при своем движении, они претерпевают взаимное притяжение, и хотя Рот находит, что для C2H4 (этилена) эта величина действительно уменьшается с возрастанием температуры, однако нельзя допустить, чтобы взятое значение ее 0,0004 на самом деле отвечало действительности; на нее нужно смотреть только как на некоторый коэффициент при далеко не совершенной, принятой для вычислений форме уравнения газового состояния.
Ч. - ↑ Напр. 1 килогр. С3H5(NO3)3, как мы видели, дает V0 = 713 лит., Qv = 1477 калор. Найдя Сv по формуле получим RT = 15829; а найдя b = 713 x 0,0004 = 0,285, имеем все данные для расчета давлений при различных Δ. Давления чистого нитроглицерина не были измерены непосредственно в бомбах, но косвенным подтверждением получаемых расчетом чисел может служить величина Т, играющая главную роль в настоящем случае, которая, как увидим, по непосредственному определению работы нитроглицерина получается близкой к вычисленной.
Ч. - ↑ Помещая нижеизложенные соображения об определении работы В. веществ, считаю необходимым указать на то, что они основаны на числах теплоемкостей и объемов, приведенных в предшествующих выносках и доныне лишь предположительных, хотя и отвечающих современности, и, сверх того, на то, что приводимые данные найдены моими наблюдениями.
Ч. - ↑ Несомненно, что в странах с развитой промышленностью военные цели требуют уже несравненно меньших количеств В. В., чем цели промышленные: напр. проведение путей сообщения (см. Взрывные работы), добыча руд, каменного угля и т. п. Впереди виден сильный рост применений сего рода при ослаблении требований В. В. для военных целей.
- ↑ Примечательно, что обращающие на себя общее внимание новые виды бездымного пороха как по своим материалам (пироксилин, нитроглицерин и т. п.), так и по своим окончательным формам (напр. порох Вьейля, Абеля и Дьюара и др.) обязаны открытием и выработкой способов производства ученым исследователям В. В. Это показывает, что здесь уже кончилась эпоха случайностей и началось дело, как всякое научное, рациональное и развивающееся в своих основах.
































![{\displaystyle W={\frac {R_{1}T}{k-1}}\left[1-\left({\frac {v_{1}-b}{v_{2}-b}}\right)^{k-1}\right],}](https://wikimedia.org/api/rest_v1/media/math/render/svg/1fe34d81736499eaac0ec90612be88b9a2368726)



![{\displaystyle 4837={\frac {0,388\times T}{1,24-1}}\left[1-\left({\frac {31-0,004}{805-0,004}}\right)^{1,24-1}\right],}](https://wikimedia.org/api/rest_v1/media/math/render/svg/e0a845f9e7705828806475ccf5ef32d4aae3d70a)













